Методы, основанные на гибридизации нуклеиновых кислот
Гибридизация — соединение одноцепочечных молекул нуклеиновых кислот в одну двунитевую молекулу. Метод используется для выявления фито патогенных бактерий, вирусов и вироидов, а также для идентификации и генотипирования штаммов грибов.
В основе метода лежит следующее физическое явление: если водный раствор ДНК нагреть до 100°С и (или) повысить pH до 13, то ДНК диссоциирует на две цепи (денатурирует), так как комплементарные связи между основаниями разрушаются. Этот процесс обратим: выдерживание ДНК при температуре 65°С ведет к восстановлению структуры двойной спирали (собственно гибридизация). Процессы гибридизации происходят между любыми одинарными цепями нуклеотидов, если они комплементарны: ДНК - ДНК, РНК - РНК, ДНК - РНК.
Широко применяемый сейчас метод гибридизации ДНК — ДНК был разработан Саузерном в 1975 г., поэтому его обычно называют "саузерн-блоттинг". В отечественной литературе часто можно встретить название "южный блоттинг". "Блоттинг" в переводе с английского означает "промокашка", "саузерн" — "южный", в данном случае присутствует игра слов: фамилия ученого переводится как географическое направление. По аналогии метод гибридизации с использованием в качестве зонда молекулы РНК называют "северный (Northern) блоттинг", и белка — "западный (Western) блоттинг".
Пример
Типовой протокол гибридизации по Э. Саузерну
Для теста необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный той последовательности, которую хотим обнаружить. Этот фрагмент получают либо клонированием, либо путем химического синтеза, после чего его количество увеличивают с помощью ПЦР. Одноцепочечная ДНК, используемая в качестве индикатора, называется ДНК-зонд. Она может содержать от 15 до 1000 нуклеотидов.
Ход работы
1. Из исследуемого объекта выделяют ДНК. Гибридизация предъявляет высокие требования к чистоте ДНК: если выделение проводилось с высаживанием ДНК хлороформом, то ее надо дополнительно очистить.
2. Выделенную ДНК нарезают на участки с помощью рестриктазы.
3. Нарезанную ДНК наносят на агарозный гель. Размер геля должен соответствовать размеру мембраны. Проводят электрофоретическое разделение. Нарезанные участки ДНК распределятся по всему гелю в соответствии со своими размерами.
4. Гель выдерживают 10 мин в растворе 0,25 моля 11С1, слегка покачивая при комнатной температуре.
5. Гель переносят в кювету с щелочным раствором Southern base (20 г NaOH, 175,25 г NaCl, дистиллированная вода — до 1 л). Инкубируют, покачивая, 15 мин при комнатной температуре. Затем раствор заменяют на новый и выдерживают в нем еще 15 мин.
6. От 100 до 500 мл раствора Southern base (в зависимости от размеров мембраны) наливают в кювету. На нее кладут стекло, на стекло — несколько листов толстой фильтровальной бумаги. Концы бумаги должны свободно свешиваться в кювету (рис. 5.1). На бумагу кладется гель (из-под геля надо тщательно убрать пузырьки воздуха стеклянной палочкой или пипеткой), на него — нитроцеллюлозная (или нейлоновая) мембрана. Мембрану надо предварительно смочить в растворе Southern base. На мембрану нужно положить три листа толстой фильтровальной бумаги, выше — толстую стопку (5—7 см) бумажных полотенец или нарезанной фильтровальной бумаги. Сверху помещается стеклянная пластинка и на нее — груз. Иногда вместо полотенец и груза используют вакуумный насос со специальной насадкой.
7. Оставляют всю конструкцию на 3—6 ч для переноса ДНК на мембрану.
8. После окончания переноса мембрану помещают в раствор Tris pH 7,5 + + 1,5 моля NaCl на 2—3 мин для нейтрализации раствора Southern base.
9. После извлечения из раствора мембрану можно высушить и хранить длительное время либо использовать немедленно для гибридизации с ранее подготовленной меткой.
10. Для гибридизации из ДНК-зонда (см. выше) надо приготовить меченую пробу. Сейчас доступны разные наборы для радиоактивного и нерадиоактивного мечения проб. Следуйте инструкции к набору.
11. Мембрана помещается в специальный буфер, состав которого зависит от способа мечения пробы. Далее намоченная мембрана помещается в специальный гибридизационный стакан и инкубируется в нем вместе с пробой в течение нескольких часов при 65°С.
12. После прохождения гибридизации мембрана извлекается из стакана, отмывается от буфера и остатков зонда, после чего помещается в кассету с фотобумагой (если метили флуоресцентной пробой) или с рентгеновской пленкой (если метили радиоактивно). На пленке произойдет засветка только в тех местах, где фрагмент исследуемой ДНК содержал последовательность, комплементарную зонду.
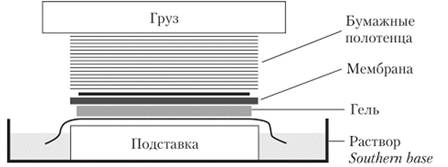
Рис. 5.1. Конструкция для переноса одноцепочечных фрагментов ДНК из геля на мембрану
Кроме диагностики патогенных объектов, зонды применяют и для других целей. Гибридизация ДНК-зонда с РНК, выделенной из анализируемой клетки, может выявить наличие или отсутствие экспрессии гена.
Метод гибридизации лежит в основе самого современного метода диагностики с использованием чипов. Чипы представляют собой пластинки
с иммобилизованными мечеными одноцепочечными ДНК-зондами. Каждая такая пластинка может содержать несколько десятков тысяч зондов, расположенных в определенной последовательности. Метка проявляется только в спаренных двухцепочечных фрагментах. Если в исследуемом образце есть последовательности, комплементарные последовательностям зонда, то гибридизацию можно определить с помощью специальных приборов. Как правило, детекторы соединены с компьютером, т.е. процедура считывания и обработки информации автоматизирована. Чипы дешевы, очень надежны, просты в обращении и могут многократно использоваться. Недостаток — дорогая аппаратура для работы с чипами.