Законы и аппроксимации как этапы дедукции
Когда научная концепция "приведена в порядок", то очевидно, что в концептуальном отношении принципы предшествуют законам. После анализа природы резонно обратиться к статусу законов. Следует различать гипотетические (дедуктивные) и индуктивные законы. Рассмотрение экспериментальных фактов позволяет в процессе индукции выявить законы. Их называют экспериментальными законами. Но индукция не является экспериментом. Строго говоря, выявленные в процессе индукции законы следует называть индуктивными, а не экспериментальными положениями. Часто ученые рассуждают об универсальных законах. Универсальные физические и химические законы выражаются так называемым "универсальным условным утверждением". Самый простой его тип записывается следующим образом:
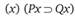 [1] (12.7)
[1] (12.7)
Это выражение читается следующим образом: для любого х, если х обладает признаком Р, то он обладает также признаком Q. Закон выражает связь признаков всех возможныхх, в связи с чем используются символьные значки переменных (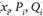 ), i пробегает ряд целочисленных значений от 1 до п, где п – общее число х.
), i пробегает ряд целочисленных значений от 1 до п, где п – общее число х.
В записи законов всегда используется представление о классе элементов. Элементы образуют определенный класс, если они обладают хотя бы одним общим признаком. Это условие выполняется. Закон имеет дело с классами элементов, а не с произвольной выборкой из их числа. В случае отказа от рассмотрения классов элементов наука приобрела бы исключительно необычный вид. История ее развития недвусмысленно свидетельствует о целесообразности рассмотрения именно классов элементов. Но это обстоятельство определяет далеко не очевидный статус научных законов.
Выше рассмотрено представление об универсальном законе. Как выясняется, оно не во всем удовлетворительно. В науке при встрече с ранее не изученными законами, строго говоря, руководствуются не универсальными, а гипотетико-дедуктив- ными законами. Они считаются справедливыми лишь для изучаемых явлений. Вполне допускается, что результаты познания вынудят отказаться от гипотетических законов. Таким образом, на них накладываются определенные ограничения.
Длительное время ученые считали, что гипотетические законы проверяются (подтверждаются) в экспериментах. Многое разъяснилось после выступлений критического рационалиста К. Поппера, который не уставал подчеркивать, что гипотетический закон не удостоверяется, а фальсифицируется. Критика Поппера была направлена против неопозитивистов, в частности, Р. Карнапа. Под натиском Поппера им пришлось отступить. Но, как ни странно, известную ошибку допускали обе стороны. Дело в том, что устанавливается индуктивный закон, а гипотетико-дедуктивный закон вводится посредством операции абдукции. И Карнап, и Поппер не проводили четкого различения между дедуктивными и индуктивными законами. Гипотетический закон фальсифицируется экспериментом. По отношению же к индуктивному закону эксперимент является его условием.
Переходим к рассмотрению дедуктивного перехода от гипотетических законов к предсказываемым фактам. В этой связи особое значение приобретает операция аппроксимации, о которой пойдет речь ниже.
Выше отмечалось, что "развертка" теории выступает как трансдукция. Применительно к квантовой химии это означает, что недостаточно всего лишь записать уравнение (закон) Шрёдингера, его еще и необходимо решить. История развития квантовой химии показывает, что в связи с этим невозможно обойтись без аппроксимаций (от лат. approximare – приближаться). Под аппроксимацией в науке обычно понимают выражение каких-либо величин через другие, признающиеся более простыми. Допустим, что рассматриваются N электронов. В рассматриваемом случае имеется в виду, что следует упрощать JV-электронную волновую функцию (N – число электронов) таким образом, чтобы она стала вычислимой. Обычно это обстоятельство интерпретируется так: при N > 2 корректное описание электронной волновой функции невозможно, поэтому не остается ничего другого, как перейти к упрощениям, сохранить теоретическое целомудрие невозможно, по крайней мере, при современном уровне науки.
По мнению автора, такого рода аргументация неглубока. Действительно, если бы был бы известен так называемый безупречно корректный подход, то можно было бы содержательно характеризовать отход от него. Но поскольку он неизвестен, то следует воздержаться от характеристики его противоположности, некорректного подхода. Теоретически содержательные аппроксимации следует понимать не как упрощения, а в качестве необходимых этапов трансдукции. В этом контексте тема упрощений имеет вторичное значение. В поддержку этого вывода приведем такой аргумент.
Достаточно часто используемые аппроксимации прекрасно согласуются с экспериментальными данными. В таком случае исследователям нет никакой нужды настаивать на их некорректности. Впрочем, эта идиллия непременно нарушается, и тогда приходится вводить более утонченные аппроксимации. Как это следует понимать? Как продолжение научной трансдукции, которая предполагает рост научного знания. Таким образом, так как трансдукцию невозможно реализовать без аппроксимаций, то они выступают ее вполне легитимными чертами. Рост научного знания вынуждает пересмотреть актуальность не всех аппроксимаций, а лишь тех их них, состоятельность которых оказалась опровергнутой. Динамику научного знания очень часто истолковывают как череду нескончаемых заблуждений. В действительности же она выступает вереницей достижений. Рост научного знания обеспечивают не заблуждения, а достижения.
Итак, аппроксимации следует интерпретировать не иначе, как в контексте трансдукции. Не случайно аппроксимации, как правило, являются результатом исключительно самозабвенной работы исследователей.
Центральное место среди всех используемых в квантовой химии аппроксимаций занимает метод Хартри – Фока, поэтому имеет смысл обратиться к нему в первую очередь.
Исторический экскурс
Весьма показательна история развития метода Хартри – Фока. Э. Шрёдингер записал свое знаменитое уравнение в 1926 г. Уже на следующий год Д. Хартри предложил метод для его решения. В этом методе волновая функция многоэлектронного атома представляется в виде произведения волновых функций отдельных электронов, соответствующих их различным квантовым состояниям в атоме. Движение каждого электрона определяется полем, создаваемым всеми другими частицами, усредненным определенным образом и задаваемым некоторыми потенциалами. Замысел Хартри состоял в стремлении дать решение уравнения Шрёдингера ab initio, то есть исходя из основополагающих квантово-механических принципов. Значимость его теоретических новаций была осознана далеко не сразу. Случилось это лишь после того, как Дж. Слэтер показал, что метод Хартри облекает в теоретическую форму вариационный принцип: одноэлектронные волновые функции выбираются из условия минимума средней энергии. В 1930 г. В. А. Фок усовершенствовал метод Хартри, придав волновым функциям форму симметрии, обеспечивающей выполнение принципа Паули, то есть он учел наличие у электронов спинов. В результате Фок увязал рассматриваемый метод с теорией групп. В 1935 г. Хартри сумел придать своему методу вид, пригодный для математических расчетов. Но их действенность выявилась лишь в начале 1950-х гг., после появления электронно-вычислительных машин. Таким образом, лишь через четверть века после первоначальной разработки метода Хартри – Фока выявилась его эффективность.
Электронное уравнение Шрёдингера для молекулярных систем часто разрешается в соответствии с так называемым методом валентных связей. В этом случае волновая функция молекулы выражается через волновые функции составляющих ее атомов. Каждой валентной связи отвечает не одноэлектронная, а двухэлектронная функция:
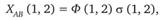 (12.8)
(12.8)
где X – пространственная, а σ – спиновая волновая функция, цифры 1 и 2 относятся к двум электронам.
При описании молекулярных систем, как правило, используются линейные комбинации волновых функций нескольких валентных связей. Коэффициенты в линейной комбинации определяют вариационным методом из условия минимума энергии.
Метод Хартри – Фока часто сопрягается с теорией возмущений, в рамках которой используется представление о невозмущенном, 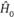 , и возмущенном,
, и возмущенном, 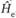 , гамильтониане. В качестве возмущения рассматривается разность между ними, а из поправок, зависящих от этой разности, учитываются лишь поправки низших порядков. Этого достаточно для получения результатов, совместимых с экспериментальными данными.
, гамильтониане. В качестве возмущения рассматривается разность между ними, а из поправок, зависящих от этой разности, учитываются лишь поправки низших порядков. Этого достаточно для получения результатов, совместимых с экспериментальными данными.
В теории молекулярных образований, содержащих многоэлектронные атомы, центральное место занимает метод функционала плотности. Основная цель теории функционала плотности состоит в замене многоэлектронной волновой функции электронной плотностью. Это ведет к существенному упрощению задачи, поскольку многоэлектронная волновая функция зависит от 3N переменных – по 3 пространственные координаты на каждый из N электронов, в то время как плотность является функцией всего лишь трех пространственных координат. Но этот метод корректен лишь в случае достаточно равномерного распределения электронной плотности. Его несомненное достоинство состоит в возможности расчета молекулярных систем, состоящих из сотен, а порой и тысяч атомов. Разумеется, при этом не обходится без использования различных приближений.
Теорию функционала плотности всегда подозревали в отходе от идеалов квантовой химии. Благодаря исследованиям П. Хоэнберга и В. Кона в значительной степени показана беспочвенность этих подозрений. Теория функционала плотности восходит к работам Л. Томаса 1927 г. и Э. Ферми 1928 г., сумевших по концепту электронной плотности рассчитать энергию атома. Считалось, что их метод был превзойден методом Хартри – Фока. Но желание справиться с расчетом многоэлектронной системы вынуждало химиков возвращаться к идеям Томаса и Ферми. Их квантовый характер во многом разъясняет вторая теорема Хоэнберга – Кона (1964 г.), согласно которой энергия электронной подсистемы, записанная как функционал электронной плотности, имеет минимум, равный энергии основного состояния, то есть она представляет собой вариационный принцип квантовой механики. Как доказывается в упомянутой теореме, волновая функция основного состояния Ф0 является функционалом электронной плотности в основном состоянии 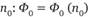 . Таким образом, концепты волновой функции и электронной плотности тесно связаны друг с другом. Это особенно очевидно для основного состояния, но не только для него. Интересно, что увлечение методом функционала плотности имеет два пика, разделенные промежутком в три десятка лет (1960-е и 1990-е гг.). В обоих случаях они были связаны с развитием вычислительной техники.
. Таким образом, концепты волновой функции и электронной плотности тесно связаны друг с другом. Это особенно очевидно для основного состояния, но не только для него. Интересно, что увлечение методом функционала плотности имеет два пика, разделенные промежутком в три десятка лет (1960-е и 1990-е гг.). В обоих случаях они были связаны с развитием вычислительной техники.
Достаточно беглый обзор химических методов[2], проведенный автором, показывает нетривиальное ОГЛАВЛЕНИЕ различных путей осуществления трансдукции в квантовой химии. Η. Ф. Степанов и Ю. В. Новаковская вполне правомерно указывают на необходимость проявления "должного внимания к тому, какие именно методы и в каком именно приближении могут и должны быть использованы при решении той или иной конкретной задачи"[3]. Путь от основополагающих законов, в частности уравнения Шрёдингера, до непосредственного контакта с экспериментальными данными и труден, и тернист. Здесь концептуальные неожиданности поджидают исследователя на каждом шагу. Но, что крайне существенно, все шаги дедукции сопряжены друг с другом.
К сожалению, очень часто трансдукцию на стадии дедукции сводят к использованию приближенных методов, якобы не соответствующих исходной строгости теории. Это ошибочное мнение рассматривается далее на примере определенных интерпретаций проблемы аппроксимаций в квантовой химии.
Ученые спорят
В этой связи исключительно большой интерес представляет статья В. Островского "Навстречу философии аппроксимаций в “точных” теориях"[4]. Правильно замечая, что проблеме аппроксимаций не уделяется должного внимания в философской литературе, он заканчивает свою статью следующими четырьмя выводами, которые здесь приведем в сокращенном виде.
1. Недопустимо рассматривать аппроксимации в качестве слабых мест "точных" наук, они в ней повсеместны. Этот вывод не опровергается наличием неоправданных приближений.
2. Научно оправданные аппроксимации – это не низшее в теориях, а отражение характеристик ее природы. Иерархия аппроксимаций создает уникальный путь воссоздания научных образов качественного характера.
3. Они являются наиболее значимыми результатами научных исследований, которые должны рассматриваться в философии науки в первую очередь.
4. Так называемые количественные методы и качественные образы, которым мы обязаны аппроксимациям, дополняют друг друга в смысле принципа дополнительности Бора.
По мнению автора, теория аппроксимаций Островского достойна высокой оценки. Разумеется, она, как и любое другое научное положение, заслуживает критического рассмотрения.
Согласно точке зрения Островского, все основополагающие научные концепты являются аппроксимациями. В частности, само уравнение Шрёдингера выступает в качестве приближения, ибо в нем не учитываются релятивистские эффекты. Можно их учесть, но тогда выяснится, что не учли размеры частиц и т.д. Все принципы также являются аппроксимациями. По мнению автора, аппроксимации занимают в трансдукции вполне определенное место, а именно, их час наступает тогда, когда совершается переход от принципов и законов к предсказываемым переменным. Крайне важно выразить метаморфозы дедукции, ее концептуальные переключения.
Мир науки не сводится всего лишь к аппроксимациям. Любая теория проблематична, а потому она заслуживает быть поставленной под огонь научной критики. Но нет никаких оснований отождествлять проблематичность теории с наличием ступеней аппроксимации в трансдукции.
В данном месте имеет смысл подчеркнуть целесообразность различения аппроксимаций и приближений. Их обычно отождествляют. Но в таком случае затрудняется постижение концептуального содержания трансдукции. Оперируя приближениями, исследователь сознательно, например, преследуя дидактические цели, отказывается от наиболее развитой теории, которая, тем не менее, витает перед его взором. Приближения – это, как правило, упрощения, отказ от рассмотрения определенных сторон изучаемой реальности. Смысл же аппроксимаций состоит не в упрощениях, а в продолжении линии трансдукции, начатой предъявлением принципов и законов. Аппроксимации освобождают от заторов на линии трансдукции.
Это обстоятельство осознается лишь в последние годы. Ярким примером такого понимания является рассматриваемая теория В. Островского. Исторически же случилось так, что аппроксимации не отличали от приближений, их смысл истолковывался в буквальном соответствии с этимологией латинского слова approximare, означающего приближение. Но в соответствии с научным строем теории аппроксимация выступает не приближением к закону (уравнению), а разверткой его потенциала. Рост научного знания приводит к переоценке уже предпринятых в процессе трансдукции аппроксимаций, но это обстоятельство не должно вводить в заблуждение. Смысл аппроксимаций и приближений различен.
В. Островский очень точно характеризует природу аппроксимаций на примере рассмотрения смысла аппроксимации Борна – Оппенгеймера, рассмотрения вопроса о наличии форм у молекул и их движения по орбитам. Его линия рассуждений, которую он называет реалистической, состоит в непременном замыкании проводимых им рассуждений характеристикой фактического положения дел. Это правильный способ аргументации, ибо недопустимо прерывать трансдукцию уже на подступах к осмыслению экспериментальных результатов. В этой связи Островский относится критически к концепту теоретического (субъективного, или идеального) артефакта, который является всего лишь подспорьем в деятельности исследователя, не имеющего прямого отношения к химической реальности.
Аппроксимация Борна – Оппенгеймера учитывает различие масс ядер и электронов (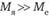 ) и их скоростей (
) и их скоростей (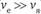 ). Если оба условия выполняются, то ядра считаются фиксированными, расположенными друг от друга на определенном расстоянии. Но если не выполняется условие
). Если оба условия выполняются, то ядра считаются фиксированными, расположенными друг от друга на определенном расстоянии. Но если не выполняется условие 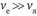 , например, применительно к некоторым возбужденным состояниям молекул, то упомянутое расстояние перестает быть признаком атомов и молекул. Островский доказывает, что введение представления о признаках атомов и молекул всегда связано с некоторыми аппроксимациями, но все они не имеют абсолютного характера, ибо если они не соответствуют химической реальности, то от них следует отказаться.
, например, применительно к некоторым возбужденным состояниям молекул, то упомянутое расстояние перестает быть признаком атомов и молекул. Островский доказывает, что введение представления о признаках атомов и молекул всегда связано с некоторыми аппроксимациями, но все они не имеют абсолютного характера, ибо если они не соответствуют химической реальности, то от них следует отказаться.
Исключительно большой интерес вызвало у ученых понятие квантовой орбиты. Некоторые методологи химической науки стали утверждать, что они не существуют[5], а являются всего лишь математическими конструктами и, следовательно, не могут быть наблюдаемыми[6]. И в оценке вопроса о реальности квантовых орбит позиция Островского представляется весьма взвешенной. Он отмечает, что в рамках аппроксимации Хартри – Фока, согласно которой каждый отдельный электрон движется под воздействием усредненного поля, образуемого нуклонами и другими электронами, представление о квантовых орбитах не только уместно, но и неизбежно. Оно имеет физический смысл. Что же касается наблюдений орбит, то они также возможны, например, в энергетическом приближении. О признаках химической реальности можно судить не иначе, как на основании аппроксимаций. С другой стороны, научно оправданная аппроксимация в той или иной форме свидетельствует о чертах самой реальности.
По мнению Островского, философское осмысление темы аппроксимаций предполагает обращение к принципу дополнительности Н. Бора. "“Точные” количественные методы и вдохновленные интуицией аппроксимации образуют дополнительную пару в универсальном смысле дополнительных отношений, существующих, по Нильсу Бору, в обществе и природе. В этом двойственном отношении количественные методы представляют более объективную сторону природы, тогда как качественные, порожденные аппроксимациями образы, остаются на субъективной стороне интерпретации природы исследователями. Очень часто мы прогрессируем в науке благодаря развитию методов аппроксимации"[7]. Несколько ранее Островский объясняет вводимую им дополнительность следующим образом: чем "точнее" уравнения, тем меньше их объяснительная сила. И, наоборот, чем выше эвристический потенциал аппроксимаций, тем они менее "точные".
По мнению автора, обращение В. Островского в попытке создать теорию аппроксимаций к принципу дополнительности Бора является философской ошибкой. Количественные и качественные определения не находятся в дополнительном, в смысле Бора, отношении друг к другу. Проще всего это можно показать, рассмотрев любую химическую переменную, например, массу атома того или иного химического элемента тi. В данном случае т – качество, а его i-я величина является количеством, mi – некоторая мера. Здесь нет отношения, предполагаемого принципом Бора, согласно которому одно уменьшается, а другое, наоборот, увеличивается. Суть дела не меняется при переходе к уравнениям, ибо в них фигурируют все те же переменные. Чем точнее решения, тем актуальнее знания о химической реальности. В данном случае нет оснований брать слово точнее в кавычки. Островский же всегда не забывает ставить слова точная (например, наука), точное (в частности, решение) в кавычки. В этом проявляется его осторожность, ибо он отлично понимает, что имеющих химический смысл точных решений не добиться без аппроксимаций. Но, обратившись к принципу Бора, В. Островский, забыв о необходимости научной бдительности, сопоставляет точное, количественное (в кавычках) с качественным (без кавычек). Только в этом случае получается столь привлекательная для него дополнительность. Несостоятельна также попытка Островского прописать объективное в основном по ведомству количества, а субъективное по ведомству качества. Эта попытка декларативна, ибо категории субъективного и объективного рассматриваются вскользь, без должной аргументации.
Отмеченные недостатки теории аппроксимаций В. Островского не отменяют ее несомненные достоинства. В его интерпретации аппроксимации выступают как далеко не рядовые концепты научной теории. Этот вывод, безусловно, заслуживает внимания. Но согласно аргументации автора, если мы хотим понять аппроксимации в систематической форме, то их следует рассматривать в контексте трансдукции. Впрочем, остаются существенные трудности в понимании внутреннего механизма трансдукции, в том числе и применительно к аппроксимациям. По мнению автора, ее следует понимать как разновидность вероятностно-игровой стратегии.
Заслуживает рассмотрения еще одна интерпретация аппроксимаций, а именно в качестве характеристики ограниченных возможностей познания. По мнению знаменитого американского физика и космолога Дж. Хартла, наше познание имеет пределы троякого рода: а) различие между наблюдаемым и предсказываемым (имеется в виду, что наблюдать мы можем очень сложные явления, а предсказывать относительно простые, ибо законы просты), б) невозможность обеспечить желаемый объем расчетов, в) ограниченные возможности познания теорий посредством индукции и их проверки[8].
Отталкиваясь от идей Хартла, итальянский химик А. Тонтини стремится установить пределы химического познания, обращая особое внимание на невозможность синтезировать желаемую химическую субстанцию[9]. По мнению автора, и Хартл, и Тонтини не обращают должного внимания на одну крайне существенную тонкость. Так называемые ограничительные теоремы указывают не на границы возможностей наших познавательных способностей, а на устройство изучаемой реальности. Соотношение неопределенностей Гейзенберга характеризует сам химический мир, а не наши познавательные способности. Прогресс познания свидетельствует о его неограниченных возможностях. Ни в физике, ни в химии не указаны такие явления, познание которых недоступно человеку. Дилемма "мир сложен – законы просты" представляет собой не научное, а умозрительное противопоставление. На основе научного материала допустимо лишь сделать вывод, что сложный мир познается посредством научных законов, а само познание лишено каких- либо границ. Познание имеет незаконченный характер, это верно, но отсюда не следует вывод, что оно бессильно перед чем- либо. Аппроксимации выражают особенности изучаемых явлений, а не наше бессилие перед их сложностью.
Выводы
1. Законы и аппроксимации являются этапами дедукции в составе трансдукции.
2. Смысл аппроксимации состоит в обеспечении дедукции.