Механизмы всасывания
Механизмы всасывания (механизмы транспорта лекарственных веществ) представлены на рис. 2.3.
Самый частый механизм транспорта лекарственных веществ – пассивная диффузия через мембраны клеток кишечной стенки (энтероцитов). Скорость всасывания в этом случае пропорциональна градиенту концентрации веществ и существенно зависит от их растворимости в мембране (наиболее легко путем пассивной диффузии всасываются липофильные неполярные вещества).
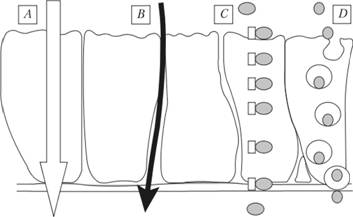
Рис. 2.3. Механизмы всасывания:
А – диффузия; В – фильтрация; С – активный транспорт; D – пиноцитоз
Диффузии, как правило, подвергаются электролиты, находящиеся в недиссоциированном состоянии. Растворимость и степень ионизации лекарственного средства определяются pH содержимого желудка и кишечника. Необходимо подчеркнуть, что лекарственные средства путем пассивной диффузии хорошо всасываются и в прямой кишке, что служит основой для введения лекарственных средств ректальным путем. Виды пассивного транспорта представлены на рис. 2.4.
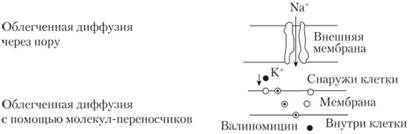
Рис. 2.4. Пассивный транспорт
Вода, электролиты и малые гидрофильные молекулы (например, мочевина) транспортируются в кровь другим механизмом – фильтрацией через поры в эпителии кишечника. Фильтрация через поры имеет значение для всасывания лекарственных средств с молекулярной массой менее 100 Да и осуществляется по градиенту концентрации.
Активный транспорт использует специализированные механизмы клеточных мембран с затратой энергии для переноса определенных ионов или молекул против градиента концентрации. Он характеризуется избирательностью, насыщаемостью. При активном транспорте наблюдается конкуренция веществ за общий транспортный механизм (например, при усвоении некоторых витаминов и минеральных веществ). Степень всасывания зависит от дозы препарата, так как возможен феномен "насыщения белков-переносчиков". Особенности активного транспорта представлены на рис. 2.5.
Основной механизм всасывания ксенобиотиков (синтезированных лекарственных веществ) – пассивная диффузия. Для веществ природного происхождения, таких как аминокислоты, витамины, эссенциальные микроэлементы и др., в организме имеются специализированные активные транспортные механизмы. В этом случае основной путь усвоения – активный транспорт, а пассивная диффузия начинает играть роль только при очень высоких концентрациях.
Лекарственные вещества с большими молекулами или комплексы лекарственного вещества с крупной транспортной молекулой всасываются путем пиноцитоза. При этом происходит инвагинация мембраны клетки кишечного эпителия и образование пузырька (вакуоли), заполненного захваченной жидкостью вместе с лекарством. Вакуоль мигрирует по цитоплазме клетки к противоположной стороне и освобождает содержимое во внутреннюю среду организма. Однако пиноцитоз не имеет существенного значения для всасывания лекарственных средств и используется лишь
в редких случаях (например, при усвоении комплекса цианокобаламина с белком – внутренним фактором Кастла).

Рис. 2.5. Активный транспорт
Современные технологии управляемого высвобождения в производстве лекарственных средств используют такие технологические приемы, как:
• использование вспомогательных веществ;
• гранулирование;
• микрокапсулирование;
• применение специального прессования;
• покрытие оболочками и т.д.
С их помощью можно изменять время распада таблетки, скорость растворения или выделения лекарственного вещества, место выделения и длительность нахождения в определенной зоне желудочно-кишечного тракта (над окном всасывания). А это, в свою очередь, определяет скорость и полноту всасывания, динамику концентрации лекарственного вещества в крови, т.е. биодоступность препарата. Для некоторых препаратов создают таблетки из микрочастиц с адгезивными свойствами, которые "приклеиваются" к слизистой оболочке, или таблетки, разбухающие в желудке настолько, что они плавают на поверхности и (или) не могут пройти через пилорический сфинктер в кишечник. На скорость распада таблеток в желудке влияет способ их производства. Так, обычные (прессованные) таблетки прочнее тритурационных (формованных). Скорость распада зависит и от вспомогательных веществ, используемых для придания необходимых свойств таблетируемой смеси (сыпучесть, пластичность, прессуемость, ОГЛАВЛЕНИЕ влаги и т.д.).
Кишечнорастворимые таблетки получают путем покрытия их желудочно-резистентной оболочкой или прессованием гранул или микрокапсул, предварительно покрытых такими оболочками. При необходимости оболочки могут обеспечивать и более длительную задержку растворения, чем на 1 ч, который таблетка проводит в желудке. Оболочка может быть достаточно толстой, например сахарной, которая иногда имеет бо́льшую массу, чем ядро таблетки, содержащее лекарственное вещество. Тонкие пленочные оболочки (менее 10% от массы таблетки) могут выполняться из целлюлозы, полиэтиленгликолей, желатина, гуммиарабика и т.д. Подбором оболочки и введением дополнительных веществ можно достичь замедления нарастания концентрации активного вещества в крови, что важно для снижения риска развития нежелательной реакции, и (или) сдвинуть время достижения максимума на несколько часов, если требуется продлить действие препарата и тем самым сократить кратность приема в целях повышения комплаентности. Таблетки пролонгированного действия (ретард), например, обычно получают прессованием микрогранул лекарственного вещества в биополимерной оболочке или распределением в биополимер- ной матрице. При постепенном (послойном) растворении основы или оболочки высвобождаются очередные порции лекарственного вещества. Современные высокотехнологичные способы доставки позволяют достичь постепенного равномерного высвобождения лекарственного вещества, например за счет создания осмотического давления внутри капсулы с действующим веществом. На этом принципе созданы новые лекарственные формы известных препаратов нифедипина (Коринфар Уно), индапамида (Индапамид ретард-Тева), пирибедила (Проноран®) тамсулозина (Омник Окас), глипизида (Глибенез ретард), тразодона (Триттико). Управляемое (контролируемое) высвобождение может достигаться использованием в таблетках микрокапсул с лекарственным веществом, покрытых специальным полимером. После растворения внешнего слоя внутрь капсулы начинает поступать жидкость и но мере растворения ядра происходят постепенное высвобождение и диффузия лекарственного вещества через мембрану капсулы. Основным фактором, ограничивающим производство и использование подобных лекарственных форм, остается условие необходимости высвобождения всего действующего начала за время прохождения таблеткой основных мест всасывания лекарственных средств в желудочно- кишечном тракте – 4–5 ч.
В последние годы для доставки лекарств применяют системы наночастиц. Наночастицы липидов (липосомы) имеют очевидные преимущества в связи с высокой степенью биосовместимости и универсальностью. Эти системы позволяют создавать фармацевтические препараты для местного, орального, ингаляционного или парентерального пути введения. Проверенная безопасность и эффективность лекарств на основе липосом сделали их привлекательными кандидатами для фармацевтических препаратов, а также вакцин, диагностических средств и нутрицевтики. Липосома в клетке показана на рис. 2.6. Липосомы похожи на пузырьки, которые состоят из многих, нескольких или только одного фосфолипидного бислоя. Полярный характер ядра позволяет улучшить доставку полярных молекул лекарственных веществ, которые необходимо инкапсулировать. Лекарство, инкапсулированное в липосому, представлено на рис. 2.7. Амфифильные и липофильные молекулы растворяются в фосфолипидном бислое в соответствии с их сродством к фосфолипидам. Формирование двухслойных ниосом возможно при участии неионных ПАВ вместо фосфолипидов.
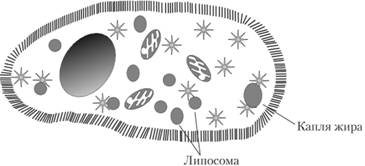
Рис. 2.6. Липосома в клетке
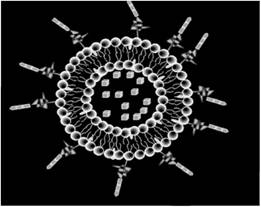
Рис. 2.7. Лекарство, инкапсулированное в липосому
Особые технологические проблемы ставят перед разработчиками комбинированные препараты, содержащие несколько активных веществ, требующих для оптимального всасывания различных условий. Разумеется, если требования к месту и времени усвоения для компонентов одинаковы, можно просто таблетировать смесь или при необходимости (например, для ограничения контакта между компонентами при хранении) предварительно гранулировать и капсулировать компоненты. Если компонентам требуются различные отделы ЖКТ для оптимального всасывания, то таблетки прессуют из гранул с разными скоростями растворения. В этом случае возможно также использование технологий многослойного таблетирования или контролируемого высвобождения. Обычно в состав комбинированного лекарственного средства не включают компоненты, отрицательно влияющие на сохранность, усвоение или фармакологическое действие друг друга.
Если компоненты комплексного препарата должны усваиваться в разное время (но в одном месте желудочно-кишечного тракта), то альтернативы раздельному приему нет.
Сублингвальное введение используют для нитроглицерина, потому что препарат немедленно поступает в общий кровоток, минуя кишечную стенку и печень. Однако большинство лекарств нельзя принимать таким способом, потому что они менее активны или обладают раздражающим действием.
Ректальное введение используют в тех случаях, когда больной не может принимать лекарство внутрь из-за тошноты, неспособности глотать или если ему нельзя есть (например, после операции). В ректальной свече ЛС смешано с легкоплавким веществом, которое растворяется после введения в прямую кишку. Тонкая слизистая оболочка прямой кишки хорошо снабжается кровью, поэтому препарат всасывается быстро, минуя печень при первом прохождении.
Инъекционный путь (парентеральное введение) включает подкожный, внутримышечный и внутривенный способы введения лекарств. В противоположность пероральному введению лекарства, вводимые парентерально, попадают в кровеносное русло, минуя кишечную стенку и печень, поэтому такое введение сопровождается более быстрой и воспроизводимой реакцией. Парентеральное введение используют для следующих ситуаций: больной не может принимать препараты внутрь, ЛС должно попасть в организм быстро и в определенной дозе, а также оно плохо или непредсказуемо всасывается.
При подкожных инъекциях иглу вводят под кожу, и ЛС поступает в капилляры, а затем уносится кровотоком. Подкожное введение используют для многих белковых препаратов, например инсулина, который при приеме внутрь переваривается в ЖКТ. Лекарства для таких инъекций могут представлять собой суспензии или относительно нерастворимые комплексы: это необходимо, чтобы замедлить их поступление в кровь (от нескольких часов до нескольких суток и дольше) и уменьшить частоту введения.
Если надо ввести большой объем ЛС, внутримышечные инъекции предпочтительнее подкожных инъекций. Для таких инъекций используют более длинную иглу.
При внутривенных инъекциях иглу вводят непосредственно в вену. Это труднее выполнить технически по сравнению с другими способами введения, особенно у людей с тонкими, подвижными или склерозированными венами. Внутривенный путь введения однократно инъекционно или непрерывно капельно является самым лучшим способом доставить лекарство по назначению быстро и в точной дозе.
Трансдермальное введение используют для ЛС, которые можно вводить в организм с помощью пластыря, прикладываемого к коже. Такие лекарства, иногда смешанные с химическими веществами, облегчающими проникновение через кожу, попадают в кровоток без инъекции медленно и непрерывно в течение многих часов, дней и даже недель. Однако у некоторых людей на коже в месте контакта с пластырем появляется раздражение. Кроме того, при таком введении лекарство может поступать через кожу недостаточно быстро. Трансдермально вводят только препараты, назначаемые в относительно небольших суточных дозах, например нитроглицерин (от стенокардии), никотин (для отвыкания от курения) и фентанил (для облегчения боли).
Некоторые лекарства, например газы, применяемые для общего наркоза, и средства для лечения бронхиальной астмы в виде аэрозоля, можно вводить в организм ингаляционным путем (вдыханием). Они попадают в легкие и оттуда поступают в кровоток. Так принимают относительно немногие препараты.
Константа скорости абсорбции (Ка) характеризует скорость поступления из места введения в кровь.
Схема фармакокинетики лекарственных средств представлена на рис. 2.8.
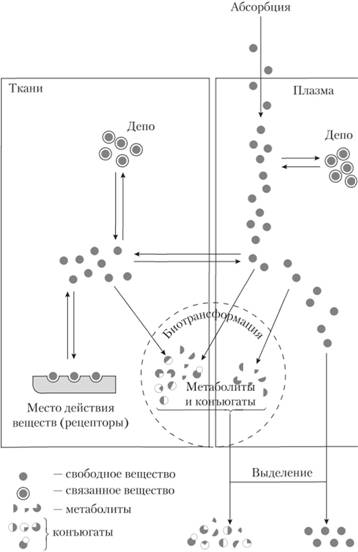
Рис. 2.8. Фармакокинетика лекарственных средств (схема)[1]
Распределение, метаболизм, выведение лекарственных средств
Распределение изменяется при повышении проницаемости гематоэнцефалического барьера (менингит, энцефалит, ЧМТ, шок, прием кофеина, эуфиллина) и снижении проницаемости гематоэнцефалического барьера (преднизолон, инсулин).
Гидрофильные соединения хуже проникают через гематоэнцефалический барьер (меньше частота побочных действий на ЦНС).
Распределение изменяется при избыточном накоплении лекарства в тканях (липофильные соединения) в случаях ожирения. Объем распределения препарата ( Vd) характеризует степень его захвата тканями из плазмы (сыворотки) крови. Vd (Vd = D/C0) – условный объем жидкости, в котором нужно растворить всю попавшую в организм дозу препарата (D), чтобы мв сыворотке крови (С0). Распределение изменяется при гипопротеинемии (гепатит, голодание, гломерулонефрит, пожилой возраст), гиперпротеинемии (болезнь Крона, ревматоидный артрит), гипербилирубинемии.
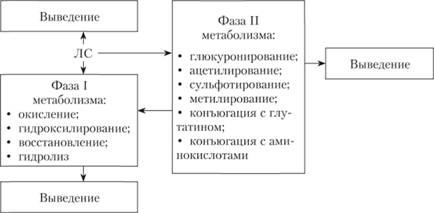
Рис. 2.9. Фазы биотрансформации лекарственных средств [2]
Фазы биотрансформации лекарственных средств представлены на рис. 2.9. Метаболизм липофильных препаратов изменяется при патологии печени (необходимо снижать дозу препаратов или кратность приемов), одновременном назначении нескольких лекарственных препаратов. Многие витамины, в частности витамин В6, являются кофакторами ферментов, метаболизирующих лекарственные средства. Так, продукты, богатые витамином В6, увеличивают скорость расщепления леводопы. Это снижает концентрацию допамина в крови. Уменьшается выраженность эффектов противопаркинсонических препаратов. С другой стороны, дефицит витамина В6 может снизить интенсивность метаболизма таких препаратов, как изониазид и др.
Общий клиренс препарата (С1t) характеризует скорость очищения организма от лекарственного препарата. Выделяют почечный (Сlr) и внепочечный (Cler) клиренсы, которые отражают выведение лекарственного вещества соответственно с мочой и другими путями (прежде всего с желчью). Общий клиренс является суммой почечного и внепочечного клиренса. Период полувыведения (T1/2) – время, необходимое для уменьшения вдвое концентрации препарата в крови, зависит от константы скорости элиминации (T1/2 = 0,693/Kel). Константы скорости элиминации (Кеl) и экскреции (Кел) характеризуют соответственно скорость исчезновения препарата из организма путем биотрансформации и выведения, скорость выведения с мочой, калом, слюной и др. Элиминация гидрофобных препаратов изменяется при патологии печени (необходимо снижать дозу препаратов или кратность приемов), сердечной недостаточности.
Элиминация препаратов изменяется при одновременном назначении лекарственных препаратов, тормозящих активность микросомальных ферментов печени (циметидин) Экскреция гидрофильных препаратов изменяется при изменениях pH мочи, снижении активной канальцевой секреции (гипоксия, инфекция, интоксикация). Реабсорбция и секреция электролитов и неэлектролитов в нефроне представлены на рис. 2.10.