Кристаллизация металлов. Строение слитка
Любое вещество может находиться в одном из четырех агрегатных состояний: твердом, жидком, газообразном и плазменном. Агрегатное состояние определяется энергией взаимодействия атомов. Стабильным (равновесным) при определенных внешних условиях является состояние вещества, при котором оно обладает минимумом свободной энергии.
Свободная энергия – часть внутренней энергии вещества.
Внутренняя энергия вещества – это сумма потенциальной энергии (энергии взаимодействия) и кинетической энергии частиц (тепловые колебания). Часть внутренней энергии, высвобождающаяся при переходе вещества из одного состояния в другое, называется свободной энергией.
Чем больше высвободится свободной энергии, тем меньшей энергией будет обладать вещество, тем более стабильно его состояние. Свободную энергию можно представить как аналог потенциальной энергии (рис. 1.18). В положении 1 шарик имеет максимальную потенциальную энергию. Это положение не является устойчивым, шарик скатывается в положение 2, при котором его потенциальная энергия будет равна 0. Вещество может находиться в метастабильном состоянии (закаленная сталь). Такое состояние не обладает минимумом свободной энергии, но является достаточно устойчивым (стабильным). Вещество в мета- стабильном состоянии может находиться бесконечно долго при условии постоянства внешних факторов.
Первичная кристаллизация металлов и сплавов
Кристаллизация – это переход металла из жидкого состояния в твердое с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества).
Рассмотрение кристаллизации для металлов и сплавов на их основе связано с тем, что эти материалы получают методом литья, тогда как многие неметаллические материалы производят другими способами. Ряд неметаллических материалов существует в природном виде (углерод), многие химические соединения получают путем химических реакций: карбиды – карбидизацией, нитриды – азотированием и т.п.
Процесс кристаллизации (затвердевания) обусловлен стремлением системы к переходу в более устойчивое термодинамическое состояние.

Рис. 1.18. Стремление системы к уменьшению свободной энергии
При изменении внешних условий, например температуры, свободная энергия системы меняется различно для жидкого и твердого (кристаллического) состояния (рис. 1.19). Выше температуры 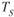 более стабильным является жидкое состояние, так как металл в этом состоянии имеет меньший запас свободной энергии. Ниже температуры
более стабильным является жидкое состояние, так как металл в этом состоянии имеет меньший запас свободной энергии. Ниже температуры 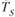 меньшим запасом свободной энергии обладает металл в твердом состоянии. При температуре
меньшим запасом свободной энергии обладает металл в твердом состоянии. При температуре 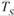 величины свободных энергий твердого и жидкого состояний равны. Это означает, что металл может находиться в обоих состояниях бесконечно долго, так как переход из одного состояния в другое не будет сопровождаться уменьшением свободной энергии. Температура
величины свободных энергий твердого и жидкого состояний равны. Это означает, что металл может находиться в обоих состояниях бесконечно долго, так как переход из одного состояния в другое не будет сопровождаться уменьшением свободной энергии. Температура 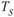 получила название теоретической температуры кристаллизации.
получила название теоретической температуры кристаллизации.
Для начала кристаллизации необходимо, чтобы свободная энергия металла в твердом состоянии стала меньше свободной энергии жидкого состояния. Это становится возможным при охлаждении жидкости ниже  . Температура, при которой фактически начинается процесс кристаллизации, называется фактической температурой кристаллизации (
. Температура, при которой фактически начинается процесс кристаллизации, называется фактической температурой кристаллизации (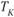 ). Охлаждение жидкого металла ниже теоретической температуры кристаллизации называется переохлаждение, а разность между теоретической и фактической температурой кристаллизации – степенью переохлаждения (
). Охлаждение жидкого металла ниже теоретической температуры кристаллизации называется переохлаждение, а разность между теоретической и фактической температурой кристаллизации – степенью переохлаждения (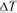 ):
):
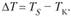
Степень переохлаждения зависит от скорости охлаждения жидкого металла. С увеличением скорости охлаждения понижается фактическая температура кристаллизации и, следовательно, возрастает степень переохлаждения.
Процесс кристаллизации можно описать с помощью кривых охлаждения, построенных в координатах "температура – время" (рис. 1.20). Охлаждение в жидком
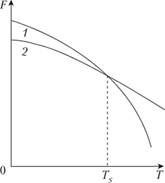
Рис. 1.19. Изменение свободной энергии (F) в зависимости от температуры (Т) жидкого (1) и твердого (2) состояния вещества
состоянии сопровождается плавным понижением температуры (участок 1 кривой охлаждения), при достижении температуры кристаллизации на кривой охлаждения появляется горизонтальная площадка (участок 2 кривой охлаждения), т.е. охлаждение (понижение температуры) останавливается.
Это вызвано тем, что отвод тепла компенсируется выделяющейся в процессе кристаллизации скрытой теплотой кристаллизации. После полного перехода металла из жидкого состояния в твердое температура вновь начинает плавно снижаться (участок 3 кривой охлаждения). Увеличение скорости охлаждения от  до
до 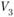 приводит к увеличению степени переохлаждения (см. рис. 1.20).
приводит к увеличению степени переохлаждения (см. рис. 1.20).
Кристаллизация начинается с образования в жидком металле центров кристаллизации и продолжается за счет роста их числа и размеров (рис. 1.21).
Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦК),

Рис. 1.20. Кривые охлаждения металла
Рис. 1.21. Схема процесса кристаллизации
образующихся в единицу времени в единице объема [1 см3/с], и скоростью роста кристаллов (СК) [мм/с]. Эти параметры зависят от степени переохлаждения, а следовательно, от скорости охлаждения при кристаллизации металла. В соответствии с законом Таммана для каждой степени переохлаждения указанные параметры могут иметь только одно значение (рис. 1.22). При теоретической температуре кристаллизации ( ) значения ЧЦК и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦК и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к
) значения ЧЦК и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦК и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к  , подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦК и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
, подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦК и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
Размер образовавшихся в процессе кристаллизации зерен зависит от соотношения величин ЧЦК и СК, т.е. определяется степенью переохлаждения (скоростью охлаждения металла в процессе кристаллизации). При малых степенях переохлаждения (низкой скорости охлаждения металла) образуется малое число центров кристаллизации, которые растут с большой скоростью, – 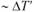 (см. рис. 1.22). В этом случае структура металла после окончания кристаллизации будет крупнозернистой. При больших степенях переохлаждения, напротив, ЧЦК велико, а СК мала (
(см. рис. 1.22). В этом случае структура металла после окончания кристаллизации будет крупнозернистой. При больших степенях переохлаждения, напротив, ЧЦК велико, а СК мала ( ), поэтому структура металла получается мелкозернистой.
), поэтому структура металла получается мелкозернистой.
Если степень переохлаждения настолько велика, что значения ЧЦК и СК близки к нулю, кристаллизации не происходит. При этом образуется твердое тело, имеющее не кристаллическое строение с "правильным" расположением атомов, а аморфное – с хаотическим расположением атомов – "твердая жидкость". Аморфное состояние характерно для неметаллических материалов (стекла, поли-
Рис. 1.22. Зависимости скорости роста кристаллов (СК) и числа центров кристаллизации (ЧЦК) от степени переохлаждения
меры). Для получения аморфного состояния у металлических материалов требуется очень большая скорость охлаждения – 106... 107 °С/с.
Модифицирование
Охлаждение с высокой скоростью для получения мелкого зерна и тем самым большей прочности металла невозможно для отливок большой массы. Измельчение зерна с целью получения мелкозернистой структуры, обладающей более высокими значениями прочности и пластичности по сравнению с крупнозернистой структурой, в этом случае достигается модифицированием – введением в жидкий металл дополнительных центров кристаллизации. Модификаторы вводят в жидкий металл в виде порошков, в небольших количествах, они практически не изменяют химического состава сплава. Модификатор должен иметь тот же тип кристаллической решетки, что и выплавляемый металл, и близкие параметры решетки (отличие не должно превышать 9%). Температура плавления модификатора должна быть выше температуры кристаллизации выплавляемого металла. Модификаторами могут быть металлы, образующие при их введении в расплав тугоплавкие химические соединения. Так, в качестве модификаторов при выплавке стали используют А1 (температура плавления 660 °С). При введении алюминия в расплавленную сталь происходит реакция обмена: 2А1 + Fe2O3 = = А12O3 + 2Fe. В результате этой реакции образуется оксид алюминия – А12O3, температура плавления которого (~2000 °С) значительно выше температуры плавления стал и.
Строение металлического слитка
Строение стального слитка впервые (в 1878 г.) описал Д. К. Чернов. Слиток имеет три характерные зоны (рис. 1.23).
Кристаллизация жидкого металла начинается у стенок изложницы, охлаждение весьма интенсивное, приводящее к образованию огромного числа центров кристаллизации. Из-за большой скорости охлажде
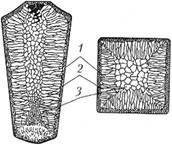
Рис. 1.23. Строение слитка (схема):
1 – зона мелкозернистого строения; 2 – зона столбчатых кристаллов; 3 – зона крупных равноосных кристаллов
ния образовавшиеся кристаллы не успевают вырасти, поэтому первая зона слитка имеет мелкозернистое строение (см. рис. 1.22).
После образования первой зоны условия кристаллизации изменяются. Снижение температуры охлаждаемого металла и повышение температуры стенок изложницы приводят к уменьшению скорости охлаждения. Для этой стадии кристаллизации характерен направленный отвод теплоты перпендикулярно стенкам изложницы. Образующиеся при этом кристаллиты растут в направлении отвода тепла, т.е. перпендикулярно стенкам изложницы, что приводит к образованию второй зоны слитка – зоны столбчатых: кристаллов.
Внутренняя часть отливки – третья зона – состоит из крупных равноосных кристаллитов. Причины такого строения – малая скорость охлаждения и отсутствие направленности отвода тепла.
Жидкий металл имеет больший объем, чем твердый, поэтому в верхней части слитка, которая застывает в последнюю очередь, образуется усадочная раковина – пустота. Усадочная раковина обычно окружена наиболее загрязненной частью металла. Верхнюю часть слитка отрезают и переплавляют, а остальной металл подвергают обработке давлением.