Взрывобезопасность смесей, содержащих пары горючих жидкостей
Одно из наибольших затруднений при оценках взрывоопасности смесей горючего с окислителем связано с влиянием давления на пределы взрываемости. Имеющиеся разрозненные данные по этому вопросу мы будем использовать на основе принципа моделирования. Хотя зависимость πкр(Ρ) и не очень сильная, соответствующая поправка к значениям пределов взрываемости, известным большей частью лишь для нормального атмосферного давления, оказывается существенной. Это обусловлено большим различием сопоставляемых давлений: экономически целесообразно для интенсификации процесса применять давления, значительно превышающие нормальное атмосферное. Будем искать зависимость пределов взрываемости от давления, принимая, что ακρ – Ρε, т.е. в виде
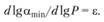 (5.6)
(5.6)
На конкретных примерах мы определим величину и степень ее постоянства для каждого объекта (ε – барический коэффициент пределов взрываемости).
Для парогазовых смесей, длительно контактирующих с жидкими компонентами и потому находящихся в состоянии равновесия испарения, возникает ряд особенностей, как способствующих обеспечению взрывобезопасности, так и вносящих осложнения. Здесь важно существование температурных пределов взрываемости. Если температура резервуара (аппарата) больше определенной минимальной величины, то ОГЛАВЛЕНИЕ горючего пара в образующейся смеси превышает верхний предел взрываемости. При этом необходим такой режим подачи воздуха в резервуар с жидкостью, который обеспечивает его насыщение паром горючего (энергичный барботаж, большая поверхность испарения). Термостатирование резервуара и насыщение воздуха паром горючего – необходимое и достаточное условие взрывобезопасности без других дополнительных ограничений.
Если подаваемый воздух не реагирует с жидкостью, то состав парогазовой фазы определяется температурой и общим давлением. По мерс охлаждения смеси и частичной конденсации избыточного горючего, флегматизирующего систему, смесь может становиться взрывоопасной. Расходование кислорода при жидкофазной реакции позволяет обеспечить взрывобезопасность всего процесса по первому принципу, если на выходе из реактора ОГЛАВЛЕНИЕ кислорода меньше Y.
Жидкофазное окисление углеводородов воздухом
В промышленности органического синтеза широко распространены процессы получения различных полимерных материалов из нефтяных углеводородов окислением воздухом. К их числу относится жидкофазное окисление циклогексана и толуола, катализируемое растворенными солями тяжелых металлов. Эти процессы связаны с опасностью образования взрывчатых паровоздушных смесей [4]; взрывоопасность процессов усугубляется тем, что их обычно проводят под давлением в несколько мегапаскалей. Рассмотрим, как сохранить газовую фазу невзрызчатой на всем протяжении технологического цикла.
В этих процессах не образуется заметных количеств летучих продуктов, кроме воды, и газовая фаза состоит из азота, кислорода, паров непрореагировавшего углеводорода и воды. Концентрация кислорода в газовом потоке, барботирующем через слой перерабатываемого продукта, постепенно уменьшается. Однако это уменьшение трудно учесть; будем считать ОГЛАВЛЕНИЕ кислорода в пределах реактора окисления равным начальному, наибольшему, наиболее опасному, что дает известный запас надежности. Принимаем далее, что концентрации углеводорода и воды в газовой фазе соответствуют равновесным, т.е. давлениям их насыщенных паров. Парогазовая смесь содержит два инертных компонента – азот и водяной пар. Чем выше температура, тем больше концентрации флегматизирующих горение избыточного горючего и инертных компонентов.
Для количественной оценки необходимы сведения о пределах взрываемости соответствующих смесей и их барических коэффициентах. Для обоих указанных горючих известны (к тому же не очень точно) только верхние и нижние пределы взрываемости воздушных смесей при нормальном атмосферном давлении. Поэтому искомые пределы оценивали по методу модельного горючего, для этого были избраны гексан и бензол, изученные более подробно.
Пределы взрываемости для гексана определены до Р = 1,2 МПа и Т= 150°С. При Р> 0,4 МПа существуют два предела взрываемости богатых смесей: один для горячего, другой для холодного пламени. Здесь существенна только возможность возникновения горячего пламени; холодное пламя не связано с заметным ростом давления, его переход в горячее исключен – по отношению к такому пламени система негорюча. Обработка данных для гексана позволяет оценить барический коэффициент emin (для αmin) уравнения (5.6): εmin = -0,36. Вводя поправку на изменение температуры, можно вычислить изотермический барический коэффициент 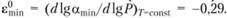 Это позволяет вычислить πкр для заданных условий.
Это позволяет вычислить πкр для заданных условий.
На рис. 5.5 представлены унифицированные значения пределов взрываемости азото-воздушных смесей модельных горючих и их бинарных смесей с кислородом (I = 0) при Р = 0,1 МПа. Приведены также известные значения пределов взрываемости воздушных смесей циклогексана и указан весь диапазон разброса πкр, по данным различных авторов достигающий 29% πкр. В дальнейшем рассмотрены процессы окисления циклогексана при общем давлении 1,8 и 3,5 МПа. Термодинамический расчет (табл. 5.2) на основе изложенных допущений дает состав парогазовой смеси.
Таблица 5.2
Расчет состава равновесных с жидкими компонентами парогазовых смесей для системы С6Н12-Н2O-воздух
|
T, °с |
Давление насыщенного пара, МПа |
Парциальное давление, МПа |
I,% |
α |
||||||
|
N2 + Н2О |
O2 |
|||||||||
|
C8H12 |
H2O |
P=1,8 |
P=3,5 |
P=1,8 |
P=3,5 |
P=1.8 |
P=3,5 |
P=1,8 |
P=3,5 |
|
|
200 |
1,3100 |
1,530 |
2,05 |
0,139 |
58,6 |
0,0154 |
||||
|
180 |
0,9470 |
0,988 |
2,22 |
0,329 |
63,5 |
0,0385 |
||||
|
160 |
0,6620 |
0,610 |
2,37 |
0,468 |
67.7 |
0,0785 |
||||
|
140 |
0,4420 |
0.357 |
1,15 |
2,49 |
0,210 |
0,567 |
63,8 |
71.2 |
0,0528 |
0,1430 |
|
120 |
0,2830 |
0,196 |
1,24 |
2,58 |
0,277 |
0,634 |
69,1 |
73,8 |
0,1020 |
0,2490 |
|
100 |
0,1720 |
0.100 |
1,31 |
2,65 |
0,321 |
0,678 |
72,6 |
75,7 |
0,2080 |
0,4390 |
|
80 |
0,0975 |
0,0467 |
1,35 |
2,70 |
0.348 |
0,705 |
75,3 |
77,1 |
0,3960 |
0,8030 |
|
60 |
0,0507 |
0,0193 |
1.39 |
2,73 |
0.363 |
0,720 |
77,2 |
78,0 |
0,7940 |
1,5800 |
|
40 |
0,0239 |
0,0073 |
1,41 |
2,75 |
0,371 |
0,728 |
78,2 |
78,5 |
1,7300 |
3,3400 |
|
20 |
0,0101 |
0,0023 |
- |
2,76 |
0,732 |
- |
78,8 |
- |
8,0600 |
|
Для каждой заданной температуры в табл. 5.2 указаны давления насыщенного пара обоих жидких компонентов; парциальное давление воздуха, а значит кислорода и азота, определяет разность Р и суммы С6Н12 + Н2O. Отсюда находим сумму Ν2 + O2, соответствующие значения I (в %) и а. Экстраполяция до 1,8 МПа (при линейной зависимости lgαкр от lgP) и 150°С позволяет вычислить значение αmin при I = 66%, близком к I искомой смеси, показанное на графике отрезком 4.
На рис. 5.5 сопоставлены равновесные составы смесей воздуха и насыщенных при различных температурах паров циклогексана и воды с пределами взрываемости для системы C6H]2-O2-N2. Здесь и в дальнейшем принимаем I = [N2] + [H2O], т.е. воду заменяем эквивалентным количеством азота; при таком предположении истинные границы области взрываемости немного уже расчетных, т.е. рекомендации по безопасности еще несколько ужесточены. На графике около каждой точки, характеризующей состав равновесной смеси, указана соответствующая ему температура. Кривые равновесных составов для Р = 1,8 и 3,5 МПа почти совпадают одна с другой, однако для каждого из этих режимов значительно различаются температуры образования аналогичных смесей.
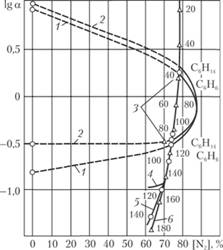
Рис. 5.5. Пределы взрываемости горючих смесей и изменение состава равновесной парогазовой смеси С6Н12 + Н2O + O2 + N2 с температурой:
1 – пределы в системе C6H4 + O2 + N2, Р = 0.1 МПа, Т = 20°С; 2 – то же, С6H6; 3 – то же, C6Η12; 4 – то же, С6Н14 + воздух, Р = 1,8 МПа, Т= 150°С; 5 – равновесная смесь С6Н12 + Н2O + воздух, Р = 1,8 МПа; 6 – то же, Р= 3,5 МПа
Чем ниже температура, тем больше α для равновесной парогазовой смеси. При определенной минимальной температуре Ткр (здесь это верхний температурный предел взрываемости) в точке пересечения кривых пределов взрываемости и изменения равновесного состава образующаяся смесь становится взрывчатой. Сопоставление показывает, что при Ρ = 1,8 МПа Ткр " 120°С. Аналогичное вычисление для Р = 3,5 МПа, менее точное ввиду далекой экстраполяции, позволяет считать, что при Т > 180°С равновесная смесь еще взрывоопасна.
Термостатирование реактора окисления гарантирует его взрывобезопасность. Однако это не исчерпывает задачи для всего технологического цикла. На последующих его этапах при охлаждении парогазовой смеси и частичной конденсации пара горючего, флегматизировавшего смесь, концентрация горючего становится меньше pmах, и система может стать взрывоопасной. При последующем охлаждении равновесная концентрация горючего достигает pmin, в данном примере для 1,8 МПа – при 40°С. Однако такое охлаждение еще не достаточно для взрывобезопасности, поскольку при быстрой конденсации насыщенного пара часто образуется устойчивый туман и ОГЛАВЛЕНИЕ горючего в гетерогенной тумано-газовой смеси будет больше, чем в равновесной парогазовой. Тумано-воздушные смеси способны взрываться; установлено [40], что по взрывоопасности они близки к гомогенным газовым смесям с равным ОГЛАВЛЕНИЕм горючего.
Безопасность последующих стадий обусловлена уменьшением содержания кислорода в газовом потоке до величины, меньшей Y, при жидкофазной реакции. Контроль температуры реактора и содержания кислорода на выходе из него достаточны для обеспечения взрывобезопасности всего процесса.
Уравнение (5.1) позволяет вычислить для циклогексана Y = 11,7%, для толуола Y = 10,8%. При более высоких температурах и давлениях значения Y, по-видимому, несколько меньше, хотя имеющиеся сведения противоречивы. Так, поданным II. Ф. Похила и др., для смесей изо-C4H10 + O2 + N2 повышение давления от 0,1 до 5,0 МПа при 150°С уменьшает Y от 10,6 до 7,6. Однако данные для смесей С4Н8 + O2 + N2 соответствуют постоянству У в диапазоне 0,1-0,5 МПа и 200-300°С (9,5-10,0%). Точно так же для смесей С4Н6 (бутадиен) + O2 + N2 в диапазоне 0,2-2,0 МПа величина У заметно не изменяется (-8,8%). В то же время, согласно [40], для воздушных смесей этилена в диапазоне 0,1-0,92 МПа величина У уменьшается с 10 до 8,7% при 20°С, а при 250°С – с 7,2 до 5,0%.
Исходя из этих фактов, можно установить в качестве допустимой концентрацию кислорода па выходе из реактора окисления, равную 7% для обоих рассматриваемых производств. Это условие практически приемлемо. Если интенсивность жидкофазной реакции почему-либо недостаточна, следует разбавлять абгазами воздух, поступающий в реактор окисления.
Установлено, что при окислении толуола, в отличие от окисления циклогексана, в реакторе нет жидкой воды. Поэтому аналогичный расчет выполнен в предположении, что [Н20] = 0; не регламентируемые количества водяного пара не учитываются, что несколько увеличивает запас надежности. Изменение состава равновесной парогазовой смеси при Р = 0,2 и 2,0 МПа показано на рис. 5.6. Определяя точки пересечения кривых равновесного состава и пределов взрываемости при различных р и интерполируя соответствующие значения температуры, можно установить зависимость критической температуры Ткр образования взрывоопасной смеси от общего давления. Так, при 0,2 МПа в точке пересечения lgα = -0,64; I = 72% N2; такой состав соответствует равновесию испарения при Т " 60°С. Зависимость Tкр(Р) для толуола представлена на рис. 5.7. Рекомендовано проводить процесс при температуре на 20-30°С выше Tкр. Погрешность определения Ткр, по-видимому, не превышает 15°С.
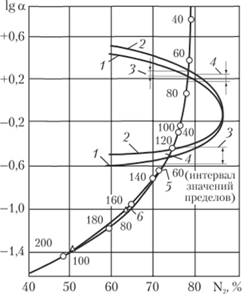
Рис. 5.6. Пределы взрываемости смесей углеводород + O2 + N2 и изменение состава равновесной парогазовой смеси C7H8 + Н2O + O2 + N2:
1 – пределы в системе C5H14 + O2 + N2, Р = 0,1 МПа; 2 – то же, С6Н6; 3 – то же, С6Н12; 4 – то же, C7H8; 5 – унифицированный предел, Р = 0,2 МПа; 6 – то же, Р = 2,0 МПа; Δ – равновесный состав, Р = 0,2 МПа;  – то же, Р =2,0 МПа
– то же, Р =2,0 МПа
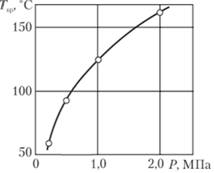
Рис. 5.7. Предельные режимы взрывобезопасного жидкофазного окисления толуола воздухом