Аспекты тепловой и цепной теорий горения
Известны два механизма самоускоряющихся превращений при горении, теории которых разработаны лауреатом Нобелевской премии Η. Н. Семёновым, – тепловой и цепной.
Тепловой механизм заключается в возрастании скорости реакции U с увеличением температуры Г, а увеличение Г обусловлено экзотермичностью реакции окисления-восстановления.
Согласно теории "теплового взрыва" разогрев в горючей смеси при ее последовательном нагреве извне обусловливается соотношением скоростей процессов тепловыделения dg1/dt и теплоотвода из зоны реакции dg2/dt и возникает тогда, когда достигается условие
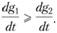 (1.10)
(1.10)
Поскольку dg1/dl = QU, где Q – тепловой эффект реакции, а 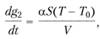
где α – коэффициент теплоотдачи в стенки реакционного сосуда, S – площадь реакционного сосуда, V – объем, Т, T0 – текущая и начальная температуры, то с повышением температуры интенсивность тепловыделения начинает обгонять интенсивность теплоотвода.
Поэтому при непрерывном нагреве горючей смеси обязательно должно достигаться условие, определяемое неравенством (1.10). Наинизшая температура, при которой достигается это условие, и есть температура самовоспламенения. Это и есть суть тепловой теории горения.
Ускорить реакцию можно не только за счет повышения температуры при саморазогреве в ходе экзотермической реакции, но и в результате особого типа химических превращений при горении – цепных разветвленных реакций.
Цепной механизм горения происходит за счет особых активных частиц – радикалов и свободных атомов, обладающих свободными валентными связями. При столкновении этих частиц с исходными молекулами или продуктами превращения взаимодействие между ними протекает при значительно меньших величинах энергии активации, чем при молекулярных процессах.
В ходе протекания цепных реакций особого рода – разветвленных – скорость реакции может бурно расти за счет того, что в результате взаимодействия активного центра с молекулой образуется несколько активных центров. От дополнительного создания активных частиц начинаются собственные цепи превращений, что приводит к еще большему накоплению активных центров и лавинообразному нарастанию скорости суммарного процесса. Однако наряду с разветвлением цепного процесса происходят реакции, ведущие к гибели активных центров или к обрыву цепей.
Окончательный результат зависит от соотношения скоростей реакций разветвления и обрыва цепей, характеризуемого выражением
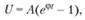 (1.11)
(1.11)
где φ = δ – β – фактор ускорения цепной реакции; δ – вероятность разветвления цепей; β – вероятность обрыва цепей; t – время; А – коэффициент, определяемый начальными условиями.
Условие цепного самовоспламенения: φ > 0.
Типичным примером разветвленной цепной реакции является окисление водорода при его горении, описываемое следующей схемой:
• Н2 + O2 → 2•OΗ – зарождение цепи;
• •OΗ + Н2 → Н2O + H• – продолжение цепи;
• Η• + O2 → •ОН + О• – разветвление цепи;
• О• + Н2 → •OΗ + H• – разветвление цепи;
• H• + H• + стенка → Н2 – гетерогенный обрыв цепи на стенке сосуда;
• H• + O2 + М → НO2 + М – гомогенный обрыв цени в объеме смеси с участием молекулярной частицы М.
Теория цепных реакций позволила объяснить многие особенности процессов горения:
• влияние на процесс горения некоторых примесей;
• существование пределов самовоспламенения подавлению;
• катализ и ингибирование горения.
Механизм возникновения и развитие реальных пожаров и взрывов характеризуются комбинированным цепочечнотепловым процессом. Начавшись ценным путем, реакция окисления за счет ее экзотермичности продолжает ускоряться за счет тепла. В конечном счете критические условия возникновения и развития горения будут определяться тепловыделением и условиями тепломассообмена реагирующей системы с окружающей средой.
Тепловые потери, способные вызвать прекращение распространения пламени, понижают температуру горения. Сюда относятся:
• отдача тепла нагретой смесью в стенки сосуда;
• отвод тепла из самой зоны реакции в стенки сосуда;
• отвод тепла из зоны реакции продуктами реакции;
• охлаждение продуктов, которое создает падение температуры при удалении из зоны реакции в направлении, обратном направлению распространения потока тепла.
В основе современной теории горения лежит понятие температуры воспламенения как основной кинетической характеристики смеси. Отсюда следуют три важных постулата:
• ниже температуры воспламенения обрыв цепей преобладает над разветвлением цепей и химическая реакция прекращается;
• выше температуры воспламенения преобладает разветвление, количество активных центров и скорость реакции неудержимо нарастают и приводят к воспламенению на верхнем пределе, где и разветвление, и обрыв цепей зависят от гомогенных химических реакций, а не от формы сосуда;
• на процессы горения определяющую роль оказывает химическая реакция, происходящая в зоне с более высокой температурой пламени, которая и определяет скорость реакции в пламени и скорость распространения пламени.