Цепное самовоспламенение. Реакция окисления водорода
Очень часто взрывной ход реакции объясняется се ценным характером, зависимостью скорости реакции от концентрации активных центров (атомов, радикалов), образующихся во время реагирования. На этом типе реакций, к которому относится и реакция окисления водорода, мы прежде всего и остановимся.
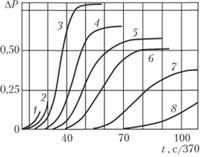
Рис. 3.4. Кинетические кривые реакции горения стехиометрической смеси водорода с кислородом при 485°С (начальные давления: 1,1 (1); 1,04 (2); 0,98 (3); 0,94 (4); 0,9 (5); 0,85 (6); 0,81 (7); 0,77 кПа (8))
Итак, цепные реакции идут через образование активных частиц. В ходе реакции количество их может увеличиться по двум причинам. Во-первых, активные частицы могут образоваться в результате теплового движения независимо от цепной реакции, поскольку молекулы исходного вещества при ударе друг о друга могут диссоциировать; скорость этого процесса мала. Во-вторых, может быть разветвление цепи, т.е. элементарный химический акт с участием одного активного атома или радикала, который приводит к образованию двух атомов (или свободных радикалов). Скорость образования активных частиц по этому пути пропорциональна их концентрации. Наличие такого источника новых частиц, пропорционального концентрации имеющихся активных частиц, весьма существенно определяет основные черты цепной кинетики. Кроме процессов, порождающих активные частицы, всегда есть процессы, которые приводят к их гибели. Если активный центр выводится из реакции при столкновении со стабильной молекулой или в результате диффузии к стенкам сосуда, то скорость этого процесса тоже пропорциональна концентрации активных центров. Выражение для изменения концентрации активных центров (п) во времени имеет, следовательно, такой вид:
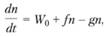 (3.42)
(3.42)
где W0 – скорость зарождения активных центров; f и g – константы скоростей процессов разветвления и обрыва цепей.
Обозначив f – g = φ, получим:
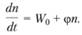 (3.43)
(3.43)
Изменение внешних условий (температуры, давления) вызывает изменение обеих величин f и g, причем f, т.е. константа, характеризующая процесс, который приводит к образованию новых активных центров через разветвление цепей, как правило, в большей степени зависит от температуры, чем g – константа реакции обрыва цепей. Это объясняется тем, что для гибели активного центра не нужна энергия активации (такие реакции идут без разрыва связи). Поэтому разность f – g = φ с повышением температуры меняет знак: при низкой температуре она отрицательна, при высокой – положительна. Из рассмотрения выражения (3.2) при естественном начальном условии t = 0, п = 0 следует, что при φ < 0, т.е. при низких температурах, концентрация активных центров стремится к пределу W0/(-j), оставаясь малой величиной, при этом dn/dt → 0.
При φ > 0, наоборот, скорость образования и концентрация активных центров непрерывно растут. Таким образом, в зависимости от знака φ тип решения резко меняется. Температура, при которой φ обращается в нуль, и будет как раз той критической температурой, ниже которой взрыв невозможен.
Эти качественные соображения объясняют существование области воспламенения гремучей смеси (см. рис. 3.3) при фиксированном начальном давлении и переходе начальной температуры через критическое значение, которому соответствует φ = 0.
Рассмотрим подробнее свойства кинетических кривых при различных φ.
Для этого найдем интеграл уравнения (3.43), удовлетворяющий условию п = 0 при t = 0:
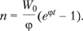 (3.44)
(3.44)
Скорость реакции, т.е. скорость образования конечных продуктов, равна
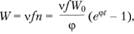 (3.45)
(3.45)
где v – целое число порядка единицы, указывающее, сколько молекул конечного продукта образуется в результате вступления в реакцию одного активного центра.
Если φ > 0, т.е. если разветвление цепей происходит быстрее, чем их обрыв, то п экспоненциально растет со временем, так же как и скорость реакции. На первых стадиях реакции, пока происходит накопление активных центров, скорость оказывается все же ниже предела измерений, так как W0 для взрывных реакций очень мала и мы практически не можем заметить превращения. По прошествии некоторого времени скорость достигает измеряемых значений и продолжает неограниченно расти. Это время соответствует введенному выше, при рассмотрении экспериментальных результатов, понятию периода индукции ti.
Кривая зависимости скорости образования конечных продуктов от времени при φ > 0 приведена на рис. 3.5, а.
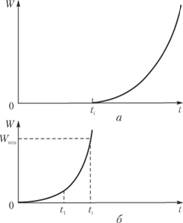
Рис. 3.5. Кривая скорости цепной разветвленной реакции во времени (а) и начальный участок этой кривой в сильно увеличенном по оси ординат масштабе (б)
На рис. 3.5, б в сильно увеличенном по оси ординат масштабе приведен начальный участок этой кривой. Скорость растет по экспоненциальному закону. По истечении времени ti скорость становится равной наименьшему доступному нашим измерительным методам значению Wmin. Только после этого момента мы и можем наблюдать реакцию.
Так как W0 для взрывных реакций всегда много меньше Wmin, то еjt при t > ti много больше единицы, и мы можем с достаточной точностью полагать
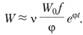 (3.46)
(3.46)
Период индукции равен, следовательно,
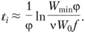 (3.47)
(3.47)
Изменением величины, стоящей под знаком логарифма, можно пренебречь, и, следовательно,
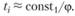 (3.48)
(3.48)
При больших φ, т.е. при f >> g,
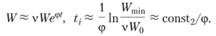 (3.49)
(3.49)
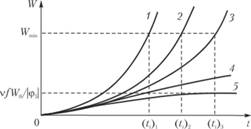
Рис. 3.6. Временная зависимость скорости цепной разветвленной реакции при различных значениях параметра φ. Кривые 1–5 соответствуют φ, > φ2 > φ3 > φ4 > 0, φ5 < 0
Изменение φ при постоянном W0 резко меняет период индукции и скорость реакции. Так, при уменьшении φ заметно увеличивается ti, а кривая скорости растягивается во времени (рис. 3.6). При уменьшении φ самоускорение процесса становится все менее и менее ярко выраженным, и, наконец, при φ = 0 кинетическая кривая имеет вид прямой (прямая 4), которая описывается уравнением
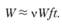 (3.50)
(3.50)
Доступная нашим измерительным методам скорость Wmin достигается по истечении времени
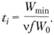 (3.51)
(3.51)
Скорость реакции и в этом предельном случае неограниченно растет до тех пор, пока не начнет сказываться выгорание.
Если еще уменьшить φ, т.е. перейти в область φ < 0, то характер процесса существенно изменится. Из формулы (3.45) следует, что при этом скорость реакции нс будет возрастать неограниченно, как при φ > 0, а будет стремиться к пределу vfW0/|φ|. Так как эта величина для взрывных реакций весьма мала (меньше Wmin то при φ < 0 реакция практически не идет.
При очень малых отрицательных φ достаточно лишь небольшого изменения внешних условий – давления или температуры, приводящих к ничтожному увеличению величины f, чтобы величина φ переменила знак и реакция начала самоускоряться.
Итак, анализ основного уравнения теории цепных реакций (3.42) показывает возможность цепного воспламенения. Это уравнение основано на самых общих простых предположениях, позволяющих выяснить физическую суть явления еще до привлечения детальных данных о кинетике и механизме химических реакций, и объясняет оба отличительных свойства взрывных систем. Во-первых, характер реакции существенно меняется при изменении параметров системы. Так, при температурах ниже критической реакция идет крайне медленно, а при более высоких температурах реакция ускоряется во времени, и скорость се достигает через некоторое время очень больших величин. Во-вторых, этим уравнением объясняется временной ход и наличие периода индукции взрывных реакций.
Заметим, что во время периода индукции химическая реакция идет, но столь медленно, что мы не можем ее наблюдать, а концентрация активных центров, вполне определенная физическая величина, все время возрастает. Согласно этим представлениям смесь, находившаяся в сосуде некоторое время, меньшее чем ti, должна отличаться от исходной тем, что в ней присутствует некоторое количество активных центров. Если взрывную смесь, соответствующую, например, по составу точке t1 (см. рис. 3.5, б), смешать со свежей взрывчатой смесью, то оказывается, что период индукции этой смеси сильно сокращается. Действительно, в системе, полученной после смешения, заранее задано некоторое количество активных центров, и скорость начинает увеличиваться с большего начального значения, реакция быстрее достигает величины Wmin. Такие опыты были проведены Η. М. Эмануэлем [27].
Применим развитые выше общие соображения к реакции окисления водорода – одной из наиболее изученных цепных реакций.
Суммарная реакция 2Н2 + O2 = 2Н2O содержит целый ряд элементарных реакций, в котором важную роль играют следующие реакции с участием активных частиц – радикала ОН и атомов водорода Н и кислорода О:
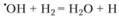 (3.52)
(3.52)
 (3.53)
(3.53)
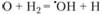 (3.54)
(3.54)
Реакции (3.52) и (3.54) имеют энергии активации, приблизительно равные соответственно 25 и 4,2 кДж/моль, и поэтому идут гораздо быстрее, чем реакция (3.53), энергия активации которой составляет 70 кДж/моль. По этой причине реакция (3.53) является лимитирующей стадией всего процесса и определяет его суммарную скорость. Участвующие в ней атомы водорода являются основными активными центрами, ведущими реакцию.
В цикле реакций (3.52)-(3.54) один атом водорода, вступивший в реакцию (3.53), вновь регенерируется в других реакциях. Складывая удвоенную первую реакцию со второй и третьей, получим суммарное стехиометрическое уравнение реакций цепи
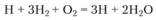 (3.55)
(3.55)
Таким образом, один атом Н, вступивший в реакцию (3.53), порождает не один (как в неразветвленной цепной реакции водорода с хлором), а три активных центра, т.е. осуществляется разветвление цепи. С энергетической точки зрения это означает, что тепло, выделяющееся в ходе основной реакции 2Н2 + O2 = 2Н2O + 476 кДж/моль, идет почти целиком на развал молекулы водорода: Н2 → 2Н – 413 кДж/моль. Поскольку скорость реакции (3.53) намного больше скорости реакции зарождения активных центров, концентрация их в разветвленной цепной реакции оказывается во много раз больше равновесной. В этом заключается основное отличие этих реакций от неразветвленных цепных реакций, в которых концентрация активных центров не может стать больше равновесной.
Сложный механизм реакции водорода с кислородом подтвержден многочисленными опытными данными, в том числе и прямым измерением концентраций активных центров Η, О, •ОН [37][1], которые оказались сверхравновесными, во много раз превышающими их термодинамически равновесные значения.
Схематически развитие реакции окисления водорода изображено па рис. 3.7. Стрелки показывают, в какие реакции вступают частицы. Внутри полуострова воспламенения достаточно одного атома водорода, чтобы вызвать появление лавины активных частиц, образование которых прекращается лишь при израсходовании исходных веществ.
Самоускорение разветвленной цепной реакции связано с тем, что скорость гибели активных частиц меньше скорости их образования. При низких давлениях порядка нескольких Паскалей под первым пределом воспламенения гибель активных частиц осуществляется в результате диффузии их к стенкам сосуда. При повышении давления скорость диффузии уменьшается, и могут быть достигнуты критические условия. На кривой АВ (см. рис. 3.3), соответствующей нижнему пределу воспламенения, скорости рождения и гибели активных центров сравниваются, т.е. φ = 0. При дальнейшем повышении давления скорость рождения активных частиц превосходит скорость их гибели из-за диффузии к стенкам, и возникает взрыв.
Обратим внимание на то, что на начальной стадии реакции, когда происходит нарастание концентрации атомов Н, тепла выделяется мало. Тепловой эффект брутто-реакции (3.55) равен всего 25 кДж на моль воды, и основное количество тепла (суммарный тепловой эффект 238 кДж па моль воды) начинает выделяться только тогда, когда концентрация атомов водорода будет уже близка к максимальной и начнется их рекомбинация, сопровождаемая большим тепловым эффектом. В начальной стадии реакции химическая энергия исходных веществ переходит не в тепловую энергию, а в химическую энергию активных частиц – атомов, что и обусловливает быстрое протекание этой реакции.
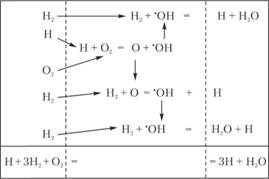
Рис. 3.7. Схема развития реакции окисления водорода
При еще большем повышении давления меняется механизм гибели активных частиц: существенную роль начинают играть реакции, идущие через тройные столкновения, такие как, например,
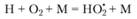 (3.56)
(3.56)
Эта реакция приводит к образованию радикала  , весьма инертного в химическом отношении и успевающего про- диффундировать к стенкам сосуда раньше, чем он вступит в реакцию. Поэтому реакцию (3.56) можно рассматривать как реакцию обрыва цепей.
, весьма инертного в химическом отношении и успевающего про- диффундировать к стенкам сосуда раньше, чем он вступит в реакцию. Поэтому реакцию (3.56) можно рассматривать как реакцию обрыва цепей.
Здесь следует заметить, что гибель радикала  на стенке существенно зависит от материала, из которого стенка сделана. Для некоторых материалов гибнут все радикалы, достигшие стенки, для других – значительная часть отражается обратно в объем сосуда без изменений.
на стенке существенно зависит от материала, из которого стенка сделана. Для некоторых материалов гибнут все радикалы, достигшие стенки, для других – значительная часть отражается обратно в объем сосуда без изменений.
С увеличением давления частота тройных соударений по реакции (3.56) возрастает быстрее, чем частота двойных соударений по реакциям (3.52)-(3.54), и скорость гибели активных центров начиная с некоторого давления превышает скорость их образования, т.е. в уравнении (3.45) величина φ снова становится отрицательной. Этим объясняется существование второго предела воспламенения на рис. 3.3 – на кривой ВС функция φ вторично меняет знак.
При дальнейшем увеличении давления диффузия затрудняется и радикал ПО), еще не достигнув стенок сосуда, начинает вступать в газофазные реакции продолжения и разветвления цепей типа следующих:
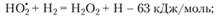 (3.57)
(3.57)
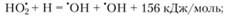 (3.58)
(3.58)
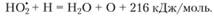 (3.59)
(3.59)
В реакциях (3.58), (3.59) выделяется значительное количество тепла, также приводящее к увеличению скорости реакции, что, в свою очередь, вызывает еще больший разогрев смеси. Если скорость тепловыделения превысит скорость охлаждения за счет теплоотдачи от стенок сосуда, то произойдет тепловой взрыв, который и обусловливает наличие третьего предела воспламенения. Это подтверждается и экспериментально[2]. Только в тех случаях, когда опыты проводятся в сосудах, стенки которого обработаны хлористым калием, воспламенение носит цепной характер[3]. Э го объясняется тем, что КС1 способствует гибели радикалов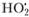 , достигших стенок сосуда. Участок кривой CD на рис. 3.3 на третьем пределе воспламенения отвечает именно таким условиям.
, достигших стенок сосуда. Участок кривой CD на рис. 3.3 на третьем пределе воспламенения отвечает именно таким условиям.
Таковы основные представления, касающиеся реакции окисления водорода, которую можно считать модельной реакцией для изучения особенностей цепных реакций. В настоящее время механизм этой реакции изучен достаточно хорошо для широкого диапазона изменения условий реагирования.
Роль активных центров при цепном превращении могут также играть молекулы, содержащие избыточный запас энергии, возникший в результате определенных элементарных химических актов. Избыточная энергия может содержаться в колебательных и вращательных степенях свободы молекул; это облегчает их взаимодействие с другими веществами, которое проходит практически без энергии активации, с большой скоростью. Такой тип цепных реакций называют реакциями с энергетическими цепями; большой вклад в их изучение внесли Дж. А. Христиансен и Г. А. Крамере и советские ученые, возглавляемые Η. Н. Семёновым.
Образование в цепных реакциях химических соединений с неравновесным распределением энергии по степеням свободы позволяет создавать источники когерентного излучения на химической реакции. В частности, подробные исследования под этим углом зрения были выполнены со смесями сероуглерода и кислорода; при ценной разветвленной реакции в этой смеси образуется молекула СО в неравновесном состоянии, что используется для создания химических СО-лазеров непрерывного действия[4].
До сих пор при объяснении факта существования критических условий и специфической формы кинетических кривых взрывных реакций мы исходили в основном из представлений о реакциях с разветвленными цепями. Однако уже при изучении процессов на третьем пределе самовоспламенения водородо-кислородной горючей смеси мы пришли к выводу о возможности другого механизма взрывных реакций, связанного с тепловым разогревом реагирующей смеси теплом, выделяющимся в результате химического превращения.