Лекция 14 ТЕРМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ И ОБЕЗВРЕЖИВАНИЯ СТОЧНЫХ ВОД
Термическими методами обезвреживаются сточные воды, содержащие минеральные соли кальция, магния, натрия и др., а также органические вещества. Такие сточные воды могут быть обезврежены концентрированием сточных вод с последующим выделением растворенных веществ; окислением органических веществ в присутствии катализатора; жидкофазным окислением органических веществ; огневым обезвреживанием.
Концентрирование сточных вод
Этот метод в основном используют для обезвреживания минеральных сточных вод. Он позволяет выделять из стоков соли с получением условно чистой воды, пригодной для оборотного водоснабжения. Процесс разделения минеральных веществ и воды может быть проведен в две стадии: стадия концентрирования и стадия выделения сухих веществ.
Концентрирование сточных вод может быть проведено выпариванием (испарением), вымораживанием и кристаллизацией.
Выпаривание является энергоемким процессом. Энергия, затрачиваемая на выпаривание, складывается из энергии на нагрев сточной воды от начальной температуры до температуры испарения; на деформирование и перенос центров парообразования; на работу, затраченную на разделение растворителя и раствора; на формирование поверхностных паровых пузырей при испарении; на преодоление сил давления при формировании пузырей; на преодоление пузырем границы раздела фаз и на транспортирование паровых пузырей до границы раздела фаз.
При расчете энергетических затрат учитывают энергию, затраченную на испарение r, и на работу разделения раствора и растворителя lр, так как остальные составляющие невелики:
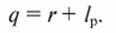 (14.1)
(14.1)
Поскольку при выпаривании с кристаллизацией выделяется теплота кристаллизации rкр, то затраты энергии на выпаривание будут
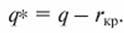 (14.2)
(14.2)
При выпаривании низкоконцентрированных растворов с кристаллизацией значение lр мало, поэтому затраты энергии на выпаривание составят
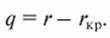 (14.3)
(14.3)
Вымораживание заключается в том, что при температуре ниже температуры замерзания чистая вода образует кристаллы пресного льда, а растворе растворенными в нем солями размещается в ячейках между этими кристаллами. Температура замерзания рассола всегда ниже температуры замерзания чистой воды и зависит от концентрации растворенных солей. Для исключения образования мелких кристаллов и отделения межкристаллитного рассола процесс вымораживания проводят при режимах медленного переохлаждения.
Разность между температурой замерзания чистого растворителя t3 и раствора называют понижением температуры замерзания раствора Δt3:
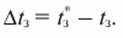 (14.4)
(14.4)
Понижение температуры замерзания для разбавленных растворов неэлектролитов пропорционально концентрации раствора:
 (14.5)
(14.5)
где k - криоскопическая константа растворителя, зависящая только от природы растворителя (но не растворенного вещества), для воды k = 1,85; m - молярная концентрация.
Вымораживание можно про водить под вакуумом или при помощи специальной холодильной установки. Наиболее распространенными хладоагентами являются аммиак, диоксид углерода, бутан, пропан, изобутан, хладоны (CC12F2, CC13F, CClF3) и их оксиды.
Кристаллизация - это процесс выделения твердой фазы в виде кристаллов из насыщенных растворов, расплавов или паров. Кристаллизацию можно осуществлять различными способами:
охлаждением растворов, расплавов и паров (изогидрическая кристаллизация);
удалением из растворов части растворителя путем выпаривания (изотермическая кристаллизация);
высаливанием;
вымораживанием;
в результате химической реакции, обеспечивающей пересыщение раствора;
воздействием высоких температур (автоклавная кристаллизация).
Вещества, растворимость которых существенно возрастает с повышением температуры (положительная растворимость), кристаллизуют при охлаждении их насыщенных растворов - это изогидрическая (политермическая) кристаллизация, идущая при неизменном содержании воды в системе. Если с ростом температуры растворимость вещества уменьшается (отрицательная растворимость), то кристаллизацию проводят при нагревании раствора.
Вещества, мало изменяющие растворимость при изменении температуры, кристаллизуют путем испарения воды при постоянной температуре - изотермическая кристаллизация.
Положительной растворимостью обладают растворы MgCl2, MgSO4, NaCl; отрицательной - растворы CaSCO4, CaSiO3, и др.
Кристаллизацию соли можно также проводить введением в концентрированный раствор веществ, уменьшающих ее растворимость. Это вещества, содержащие одинаковый ион сданной солью или связывающие воду. Кристаллизацию такого типа называют высаливанием.
Распространенным видом кристаллизации является химическое осаждение вещества из растворов с применением реагентов. Например, примеси ионов металлов осаждают в виде гидроксидов, добавляя в раствор щелочи.
Для оценки поведения растворов при их кристаллизации и рационального выбора способа проведения этого процесса используют диаграммы состояния растворов, выражающие зависимость растворимости солей от температуры. Скорость процесса кристаллизации зависит от степени пересыщения раствора, температуры, интенсивности перемешивания, содержания примесей и др., она изменяется во времени, проходя через максимум.
Для оценки поведения системы кристалл-раствор или кристалл-расплав в широком диапазоне температуры, давления и концентрации используют диаграмму состояния (фазовую диаграмму), на которой графически изображается равновесие между различными фазами данной системы. Связь между числом компонентов К, числом фаз Ф и числом степеней свободы S данной системы устанавливается правилом фаз (уравнением Гиббса):
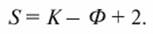 (14.6)
(14.6)
Число степеней свободы S данной системы соответствует числу независимых параметров, характеризующих эту систему (температура, давление, концентрация).
Фазовое равновесие однокомпонентной системы определяется двумя параметрами: температурой и давлением. В соответствии с правилом фаз число степеней свободы одно компонентной системы при условии равновесия двух фаз равно 1, следовательно, в однокомпонентной системе только один параметр может независимо изменяться без изменения числа фаз - давления или температуры.
На фазовое равновесие двухкомпонентных (бинарных) систем могут оказывать влияние три параметра: температура, давление и концентрация. Однако при кристаллизации из растворов основной интерес представляют жидкая и твердая фазы данной системы. Поскольку давление незначительно влияет на равновесие между жидкостью и твердой фазами, фазовое равновесие может быть представлено на диаграмме температура - концентрация.
Процесс кристаллизации состоит из двух последовательных стадий: образование зародышей кристаллов и рост кристаллов. Образование зародышей кристаллов происходит в пересыщенных растворах, когда пересыщение достигает определенной величины. Разность между концентрацией раствора, при которой начинают образовываться зародыши, и концентрацией насыщенного раствора называют максимальным пересыщением.
Пересыщенные растворы характеризуют разностью между концентрациями пересыщенного Сп и насыщенного С* растворов, относительным пересыщением (Сn - С*)/С* или коэффициентом пересыщения Сn/С*.
Растворимость кристаллов увеличивается с уменьшением их размеров. Очень мелкие кристаллы растворяются даже в пересыщенных растворах. Таким образом, для каждого пересыщения существует минимальный размер кристалла, обеспечивающий устойчивость его при данном пересыщении и равновесие с раствором. Кристаллы, имеющие размер меньше этого минимального, будут растворяться, а кристаллы, имеющие размер больше критического, будут расти.
После возникновения в пересыщенном растворе зародышей кристаллов с размерами, большими критических, на их поверхности начинает отлагаться кристаллизуемое вещество. Линейная скорость роста кристалла, т.е. скорость увеличения размера кристалла в направлении нормали к грани кристалла, является основной характеристикой этой стадии процесса кристаллизации.
Для зародыша сферической формы работа образования равна
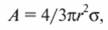 (14.7)
(14.7)
где r - размер зародыша; σ - коэффициент поверхности ого натяжения.
Размер зародыша, находящегося в равновесии с пересыщенным раствором, обратно пропорционален логарифму степени пересыщения:
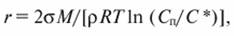 (14.8)
(14.8)
где М - молярная масса твердой фазы; ρ - плотность вещества; R - универсальная газовая постоянная; Т - абсолютная температура.
Вероятность образования зародышей возрастает с повышением температуры. Этому процессу способствуют механическая вибрация, перемешивание, воздействие акустического и магнитных полей.
Рост кристаллов происходит в результате диффузии вещества из основной массы раствора к поверхности растущего кристалла с последующим включением частиц растворенного вещества в кристаллическую решетку.
Скорость диффузии частиц к поверхности кристалла определяется по уравнению
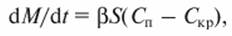 (14.9)
(14.9)
а скорость роста кристалла
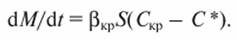 (14.10)
(14.10)
Общее уравнение скорости кристаллизации имеет вид
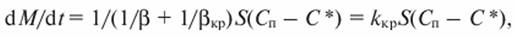 (14.11)
(14.11)
где М - количество диффундирующего вещества; t - время; β и βκρ - коэффициенты массоотдачи и процесса кристаллизации; S - площадь поверхности кристалла; Скр - концентрация вещества у поверхности кристалла; kкр - коэффициент скорости кристаллизации.
Некоторые примеси в растворе увеличивают скорость кристаллизации, другие уменьшают.