Молекулярная энергетика горения
Большинство процессов горения представляет собой соединение горючих, содержащих водород и углерод, с кислородом воздуха.
Прежде чем перейти к рассмотрению физических и математических основ теории горения, постараемся понять на молекулярном уровне, откуда происходит энергия горения, от выделения которой зависит все остальное: нагрев газа, появление в нем активных химических центров и т.д.
Посмотрим, из чего складываются теплоты основных реакций соединения углерода и водорода с кислородом воздуха.
Запишем в соответствии с данными табл. 3.1 энергетический баланс реакций последовательного окисления твердого углерода, например графита:
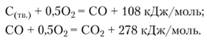
Таким образом, в суммарной реакции окисления твердого углерода выделяется 386 кДж/моль:
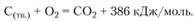
Близка по величине и энергия, выделяющаяся при соединении водорода с кислородом:
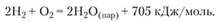
Молекула СО является едва ли не самой прочной, ее энергия связи равна 1016 кДж/моль. (Следующей по прочности является молекула N2 с энергией связи 892 кДж/моль. В обеих молекулах имеются три пары связывающих электронов, на химическом языке – три валентные связи. В молекуле СО сначала один электрон переходит от О к С, после чего O+ и С- становятся похожими на атомы азота; это подтверждается наличием у молекулы СО дипольного момента.) В молекуле СO2 связь второго атома кислорода слабее: согласно табл. 3.1
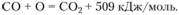
Энергии связи кислорода в этих соединениях сравнимы с энергией связи исходной молекулы кислорода. Так как
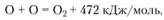
то на один атом кислорода приходится всего 240 кДж/моль. В малой энергии связи молекулы кислорода причина его химической активности и причина применения окисления в качестве источника энергии.
Энергия связи атома углерода в кристаллической решетке графита (а также алмаза и аморфного углерода) очень велика. Сравнительно небольшая энергия реакции С(тв) + 0,5О2 = = СО + 98 кДж/моль есть разность двух очень больших величин: из энергии связи СО (256 кДж/моль) нужно вычесть половину энергии разрыва O2 на атомы (59 кДж/моль) и вычесть теплоту испарения атома углерода. Собственно, так и определяется теплота испарения, равная 671 кДж/моль. Это также очень большая величина.
Превращение твердого углерода и газообразного водорода в углеводородные топлива происходит с малым изменением энергии. С другой стороны, при введении кислорода в органические молекулы тина спиртов, альдегидов и кетонов, органических кислот, углеводов выделяется почти столько же энергии, сколько выделяется при полном сгорании (до СO2 и Н2O), естественно, при потреблении равного количества кислорода. Поэтому приближенно можно считать, что при полном сгорании любого органического топлива выделяется 419-500 кДж/моль израсходованного кислорода. Исключение составляют только некоторые эндотермические, богатые энергией соединения, такие, например, как ацетилен и дициан, их теплота горения больше.
Неполное сгорание энергетически невыгодно не только в расчете на молекулу горючего, но и на молекулу затраченного кислорода. В реакции 2Q(тв) + O2 = 2СО выделяется только 210 кДж/моль вместо 466 при сжигании водорода и 526 при сжигании СО.
Сильная связь атома С в твердом углероде приводит к тому, что углерод не испаряется. Углерод покидает твердое состояние только вместе с кислородом в форме СО или СO2.
При неполном сгорании и низкой температуре реакция 2СО = СO2+ С(тв)) + 41 кДж/моль энергетически выгодна лишь при расчете на твердый углерод. При расчете на свободный атом углерода соответствующая реакция 2СО = СO2 + С – 129 кДж/моль имеет большой энергетический барьер. Поэтому сажа и копоть при горении образуются лишь от разложения органических молекул, имеющих углеродный скелет, но не из СО.
Теперь обратимся к реакциям окисления с участием азота.
Молекула азота N2 является очень прочной – ее энергия диссоциации равна 226 кДж/моль. Поэтому реакция превращения N2 и O2 в 2NO является эндотермической и уже по термодинамическим соображениям может идти только при высокой температуре.
Образование высших оксидов (NO2, N2O3, N2O4, N2O5) из азота и кислорода идет практически без изменения энергии (по сравнению с энергией связи N2 и O2). Поэтому с энергетической точки зрения кислород, упакованный в соединения с азотом (CH3-ONO2 – нитроэфир, CH3(CeH2)(NO2)3 – тринитротолуол), практически равноценен газообразному кислороду. Встроенный в органическую молекулу, но связанный с азотом кислород позволяет создать вещества, выделяющие большую энергию при перегруппировке молекулы с образованием N2 и переходом кислорода в молекулы СO2 и Н2O. По этой причине соединения, в которых кислород связан с азотом (а также с хлором, в группах СЮ3, СlO4), используются в качестве порохов и взрывчатых веществ.
Таковы общие представления о молекулярной энергетике горения.