Полиморфные превращения в кристаллических веществах
Ряд неорганических веществ – металлов и неметаллов – в зависимости от внешних условий имеет разные
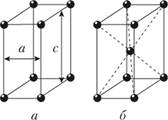
Рис. 1.9. Тетрагональная кристаллическая решетка:
а – простая; б – объемно- центрированная
кристаллические решетки. Это явление называется полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными, или аллотропными, модификациями, а превращение одной модификации кристаллической решетки в другую – полиморфным превращением. Эти превращения происходят при изменении температуры и (или) давления. При данных внешних условиях существует стабильный тип кристаллической решетки, обладающий меньшей свободной энергией (более подробно это понятие рассмотрено ниже, см. 1.3.5).
Явление полиморфизма характерно для большого количества металлов. Различные модификации одного и того же вещества индексируют буквами греческого алфавита: низкотемпературную модификацию называют a, a высокотемпературные модификации – 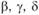 и т.д. В качестве примера приведем железо и титан. Железо до температуры 910 °С имеет решетку ОЦК –
и т.д. В качестве примера приведем железо и титан. Железо до температуры 910 °С имеет решетку ОЦК – 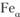 , выше – решетку ГЦК –
, выше – решетку ГЦК – 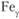 ; титан до температуры 882 °С имеет кристаллическую решетку ГПУ –
; титан до температуры 882 °С имеет кристаллическую решетку ГПУ – 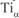 , выше – ОЦК –
, выше – ОЦК –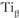 . Полиморфные превращения претерпевают и сплавы па основе металлов, обладающих полиморфизмом.
. Полиморфные превращения претерпевают и сплавы па основе металлов, обладающих полиморфизмом.
Полиморфизмом обладают и неметаллические неорганические материалы. Наиболее яркий пример – полиморфное превращение углерода. При высоких температурах углерод в виде графита, имеющего слоистую структуру, превращается в алмаз – материал со сложной кубической решеткой.
Аналогичное свойство имеют и некоторые химические соединения. Так, диоксид циркония (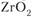 ) при высокой температуре имеет тетрагональную решетку, при низкой – моноклинную. Кристаллическая решетка низкотемпературных модификаций боридов вольфрама (
) при высокой температуре имеет тетрагональную решетку, при низкой – моноклинную. Кристаллическая решетка низкотемпературных модификаций боридов вольфрама (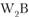 ) и молибдена (
) и молибдена (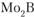 ) – тетрагональная; высокотемпературных – ромбическая.
) – тетрагональная; высокотемпературных – ромбическая.
Используя полиморфные превращения, можно целенаправленно менять свойства конструкционных и инструментальных материалов, широко применяемых в машиностроении.
Анизотропия кристаллов и изотропия кристаллических тел
Атомная плотность – количество атомов на единицу площади – неодинакова для разных плоскостей кристаллической решетки. Например, в объемно-центрированной кристаллической решетке плотность атомов в заштрихованном квадрате площадью 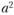 (рис. 1.10) равна
(рис. 1.10) равна 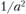 , так как каждый из четырех атомов в этой плоскости принадлежит четырем элементарным ячейкам. Площадь заштрихованного прямоугольника той же кристаллической решетки равна
, так как каждый из четырех атомов в этой плоскости принадлежит четырем элементарным ячейкам. Площадь заштрихованного прямоугольника той же кристаллической решетки равна 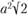 , атомная плотность равна
, атомная плотность равна 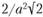 . В рассматриваемой плоскости имеются два собственных атома. Каждый из четырех атомов в этой плоскости принадлежит четырем элементарным ячейкам, а атом в центре ячейки – только этой одной ячейке (т.е. количество атомов в этой плоскости 4-1/4 + 1 = = 2). Аналогично неодинаково межатомное расстояние в рассмотренных плоскостях. Поскольку силы межатомного взаимодействия зависят от межатомного расстояния, свойства кристалла в различных плоскостях и направлениях кристаллической решетки будут неодинаковыми. Неодинаковость свойств по разным кристаллографическим направлениям называется анизотропией.
. В рассматриваемой плоскости имеются два собственных атома. Каждый из четырех атомов в этой плоскости принадлежит четырем элементарным ячейкам, а атом в центре ячейки – только этой одной ячейке (т.е. количество атомов в этой плоскости 4-1/4 + 1 = = 2). Аналогично неодинаково межатомное расстояние в рассмотренных плоскостях. Поскольку силы межатомного взаимодействия зависят от межатомного расстояния, свойства кристалла в различных плоскостях и направлениях кристаллической решетки будут неодинаковыми. Неодинаковость свойств по разным кристаллографическим направлениям называется анизотропией.
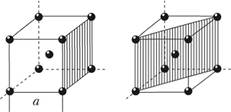
Рис. 1.10. Анизотропия кристаллической ячейки
Технические металлы являются поликристаллическими веществами и состоят из большого количества мелких кристаллов, различно ориентированных по отношению друг к другу. Эти кристаллы вследствие условий кристаллизации имеют неправильную форму и называются зернами, или кристаллитами. Произвольность ориентации каждого зерна приводит к тому, что в разных направлениях свойства усредняются и становятся практически одинаковыми, т.е. поликристаллическое тело изотропно. Это явление называется квазиизотропией (ложной изотропией). Она не наблюдается в том случае, если кристаллы имеют одинаковую ориентировку (текстуру) в каких-то направлениях. Такая ориентированность создается в результате пластической деформации. В этом случае поликристаллический металл приобретает анизотропию свойств.