Теплота реакции
Одной из главных величин, характеризующих термодинамические свойства реагирующей системы, является энтальпия, или теплоОГЛАВЛЕНИЕ:
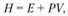 (3.24)
(3.24)
где Е – полная внутренняя энергия газа; Р – давление; V – объем газа. Для идеальных газов теплоОГЛАВЛЕНИЕ, в которое включается и химическая энергия, является функцией только температуры, но не давления. Энтальпию каждого химического элемента в определенном стандартном состоянии принимают за нуль, что позволяет учесть вклад химической энергии в энтальпию различных соединений и, далее, установить зависимость энтальпии смеси газов от состава.
Пусть в условиях постоянного давления прореагировала исходная смесь, содержащая νi молей веществ Аi, что привело к образованию 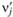 молей продуктов реакции
молей продуктов реакции 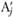 согласно реакции (3.2). Выделившееся (или поглотившееся) в таком процессе тепло (после медленного охлаждения смеси до начальной температуры) называется теплотой реакции. Применим к этому процессу первый закон термодинамики, согласно которому тепло, выделившееся в системе, равно
согласно реакции (3.2). Выделившееся (или поглотившееся) в таком процессе тепло (после медленного охлаждения смеси до начальной температуры) называется теплотой реакции. Применим к этому процессу первый закон термодинамики, согласно которому тепло, выделившееся в системе, равно
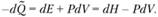 (3.25)
(3.25)
Если горение происходит при постоянном давлении, т.е.
dP = 0, находим что теплота реакции равна 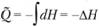 – разности полных энтальпий системы в начальном и конечном состояниях. Если же сгорание произошло в закрытом объеме (а именно таким образом проводятся калориметрические эксперименты для определения стандартных теплот реакций), то dV = 0 и теплота реакции при постоянном объеме выражается как
– разности полных энтальпий системы в начальном и конечном состояниях. Если же сгорание произошло в закрытом объеме (а именно таким образом проводятся калориметрические эксперименты для определения стандартных теплот реакций), то dV = 0 и теплота реакции при постоянном объеме выражается как
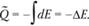 (3.26)
(3.26)
В дальнейшем все изложение основ термодинамических расчетов при горении будем вести для случая постоянного давления, для постоянного объема методы расчетов аналогичны.
В зависимости от того, выделяется (Q > 0) или поглощается (Q < 0) тепло в ходе химического превращения, различают экзотермические и эндотермические реакции.
Так как полная энтальпия смеси газов равна сумме теплосодержаний всех ее компонентов, то
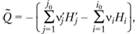 (3.27)
(3.27)
где 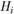 и
и  – энтальпии, приходящиеся на моль i-го исходного вещества и j-го продукта реакции.
– энтальпии, приходящиеся на моль i-го исходного вещества и j-го продукта реакции.
Поскольку в рассматриваемом процессе приток тепла является полным термодинамическим дифференциалом, то теплота реакции не зависит от пути, по которому идет процесс. В частности, если осуществить процесс в несколько стадий, то теплота реакции будет равна сумме теплот, выделившихся на каждой стадии процесса (закон Гесса). Это обстоятельство используют для расчета теплоты реакции следующим образом. Пусть в исходной смеси сначала идут реакции разложения каждого компонента па составляющие его элементы, находящиеся в некотором определенном (стандартном) состоянии, а затем эти элементы, соединяясь, образуют продукты реакции. Введем стандартную теплоту образования i-го вещества ΔН*i как взятую с обратным знаком теплоту реакции, в которой образуется один моль i-го вещества из составляющих его элементов, находившихся в стандартном состоянии. Тогда теплота реакции, происходящей в стандартных условиях (обычно Рс = 1 атм, Тс = 25°С), равна
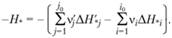 (3.28)
(3.28)
В табл. 3.1 даются стандартные теплоты образования нескольких веществ, которые часто употребляются в термодинамических расчетах процессов горения. Стандартным состоянием элемента считается его термодинамически равновесное состояние в стандартных условиях. При этом ΔН = 0.
Таблица 3.1
Теплоты образования некоторых веществ из элементов в стандартных состояниях
|
Вещество |
-ΔΗ*, кДж/моль |
Вещество |
-ΔΗ*, кДж/моль |
|
|
Атом кислорода О (г.) |
241,15 |
Молекула хлора С12 (г.) |
0 |
|
|
Молекула кислорода O2 (г.) |
0 |
|||
|
Оксиды хлора (г.): |
||||
|
Озон О3 (г.) |
131 |
СlO |
92,3 |
|
|
Атом водорода Н (г.) |
211,1 |
СlO2 |
109 |
|
|
Молекула водорода Н2(г.) |
0 |
С12O |
73,4 |
|
|
Хлорноватистая кислота НОС1 (г.) |
-90,1 |
|||
|
Вода: Н2O (г.) |
-232,8 |
|||
|
Фтористый водород HF (г.) |
-241,3 |
|||
|
Н2O (ж.) |
-278,3 |
|||
|
Радикал Н02 (г.) |
16,2 |
Хлористый водород НС1 (г.) |
-84,1 |
|
|
Перекись водорода Н2O2 (ж.) |
-178,7 |
|||
|
Бромистый водород НВг (г.) |
-33,1 |
|||
|
Гидроксил ОН (г.) |
32,1 |
|||
|
Атом серы S (г.) |
260 |
|||
|
Атом хлора С1 (г.) |
112 |
|||
|
Оксиды серы (г.): SO2 |
382 |
Углерод С: Графит |
0 |
|
|
SO2 |
-216 |
Алмаз |
1,16 |
|
|
SO3 |
-381 |
С (г.) |
676 |
|
|
S2O |
-114 |
С2 (г.) |
803 |
|
|
SH |
146 |
Оксид углерода СО (г•) |
-96,4 |
|
|
Сероводород H2S (г.) |
-20,8 |
|||
|
Атом азота N (г) |
442 |
Углекислый газ СО2 (г.) |
-376 |
|
|
Молекула азота N2 (г.) |
0 |
|||
|
НСО (г.) |
-22,3 |
|||
|
Оксид азота NO (г.) |
83,4 |
|||
|
СН (г.) |
423 |
|||
|
Диоксид азота NO2 (г.) |
32,4 |
|||
|
СН2 (г.) |
268,8 |
|||
|
Другие оксиды азота (г.): N2O3 |
80,6 |
Метил СН3 (г.) |
128 |
|
|
Метан СН4 (г.) |
-71 |
|||
|
Этан C2H6 (г.) |
-81,3 |
|||
|
N2O4 |
8,9 |
Пропан С3Н8 (г.) |
-96,9 |
|
|
N2O5 |
-10,2 |
Этилен С2Н4 (г.) |
48,6 |
|
|
Закись азота N20 (г.) |
80,8 |
Ацетилен С2Н2 (г.) |
221 |
|
|
NH (г.) |
331,2 |
CS (г.) |
219 |
|
|
NH2 (г.) |
171,2 |
Сероуглерод CS2 (ж.) |
85,2 |
|
|
Аммиак NH3 (г.) |
-45,3 |
COS (г.) |
-136 |
|
|
Гидразин N2H4 (ж.) |
48,1 |
CN (г.) |
326 |
|
|
HCN (г.) |
125 |
Обозначения: (г.) – газ; (ж.) – жидкость.
Еще раз подчеркнем, что теплота реакции существенно зависит от того, в каком конечном состоянии взять вещество, например воду в виде пара или в виде жидкости, углерод в виде графита или алмаза (т.е. от кристаллической структуры) и т.п.
Для оценки стандартной теплоты образования можно пользоваться значениями энергий разрыва химических связей. Энергия разрыва химической связи (или энергия связи) есть та энергия, которую нужно затратить, чтобы отделить друг от друга (развести па большое расстояние) два атома (или две группы атомов), соединенные этой связью.
Значения энергий (в стандартных условиях) приведены в табл. 3.2 (данные взяты из [3, 17, 20]); предполагается, что невозбужденные атомы или молекулы находятся в состоянии идеального газа.
С помощью значений энергий связей, пользуясь законом Гесса, можно вычислить теплоты образования различных соединений из свободных атомов и, следовательно, найти теплоты химических реакций.
Для примера рассчитаем теплоту реакции 2Н2 + O2 = = 2Н2O поданным табл. 3.1 и 3.2. Согласно данным табл. 3.1 теплоты образования исходных веществ (Н2 и O2) равны нулю, а теплота образования молекулы воды равна 227,8 кДж/ моль; таким образом, находим, что теплота реакции, про водящейся в стандартных условиях, равна -ΔН* = = 460,81 кДж/моль.
Таблица 3.2
Энергия разрыва связей
|
Реакция |
Энергия связи, кДж/моль |
Реакция |
Энергия связи, кДж/моль |
|
Cl2 → 2С1 |
242,44 |
SO2– SO2 + O |
347,78 |
|
Н2 → 2Н |
431,8 |
С2 → 2С |
604,43 |
|
НС1 → Н + С1 |
430,9 |
CºCH → C+ CH |
798,38 |
|
НО → Н + О |
459,8 |
НСºСН → 2СН |
961,4 |
|
H2O → OH + H |
498,3 |
Н2С=СН → СН2 + СH |
711,85 |
|
Н2O2 → 2OН |
234,08 |
Н2C=СН2 → 2СН2 |
711,44 |
|
HS → S + H |
348,6 |
CH → C + H |
338,58 |
|
N2 → 2N |
944,26 |
HCO → CO + H |
77,33 |
|
NH → N + Н |
313,08 |
HCN → Н + CN |
509,96 |
|
NH3 → NH2 + H |
437,65 |
CH4 → CH3 + H |
434,72 |
|
NO → N + О |
630,76 |
HCºCH → С2Н + H |
501,6 |
|
NO2 → N + O2 |
438,9 |
C2H6 → С2Н5 + H |
409,64 |
|
NO2 → NO + O |
305,56 |
CO → C + O |
1075,96 |
|
N2O → NO + N |
167,2 |
CO2 → CO + O |
531,69 |
|
O2 → 2O |
493,24 |
HCO → CH + O |
812,17 |
|
O3 → O2+ О |
107,1 |
CN → С + N |
760,34 |
|
S2 → 2S |
425,11 |
HCN → СН + N |
932,14 |
|
SO → S + О |
521,25 |
CS → С + S |
713,11 |
|
SO2 → SO + О |
550,1 |
CS2 → CS + S |
440,57 |
Чтобы использовать для расчета теплоты реакции значения энергий связей, будем считать, что реакция проводится следующим образом. Сначала разрываются химические связи в исходных веществах, т.е. две связи Н-Н и одна связь О-О; согласно данным табл. 3.2 при этом затрачивается энергия 2-103,3 + 118,0 = 1356,83 кДж/моль. Затем из образовавшихся четырех атомов водорода и двух атомов кислорода образуются две молекулы воды; при этом происходит образование четырех связей О-Н, сопровождающееся выделением энергии 16•110= 1760 кДж/моль. Таким образом, теплота реакции равна 1760 – 1410 = 350 кДж/моль. Это значение хорошо согласуется со значением, полученным выше с помощью данных табл. 3.1.
В общем случае энергия связи двух атомов зависит от того, в какой молекуле находятся эти атомы, т.е. от того, с какими атомами или группами атомов они связаны. Примером является значение энергии связи С-Н в различных предельных углеводородах.
Отметим прежде всего существенное различие двух таблиц.
В таблице энтальпий встречаются как положительные (нужно затратить энергию для получения данного вещества из элементов в стандартном состоянии), так и отрицательные величины. Можно говорить соответственно о богатых энергией соединениях и о соединениях, бедных энергией. Как правило, богатые соединения неустойчивы, бедные энергией соединения устойчивы.
В противоположность этому в таблице энергий связи все величины положительны. Это значит, что молекулы, которые могли бы самопроизвольно распасться на части, в таблице отсутствуют. Это наблюдение проливает свет на понятия "богатый энергией" и "неустойчивый" применительно к первой таблице.
Обратимся к примеру. Ацетилен неустойчив: распад С2Н2 = 2С (тв.) + Н2 дает 226,8 кДж/моль в стандартных условиях ((тв.) – твердый). Однако легко подсчитать, что ацетилен устойчив относительно любого элементарного процесса:
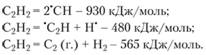
Значит, одиночная молекула ацетилена распадаться не может.
Распад ацетилена сопровождается выделением энергии именно потому, что в действительности происходит не простой распад на составные части, а перегруппировка. Так, образующиеся в последней реакции молекулы С2, находящиеся в газовой фазе, могут конденсироваться в твердый углерод (графит), выделяя 792 кДж/моль. Это выделение энергии перевешивает затрату энергии на разложение ацетилена (565 кДж/моль). Энергия ацетилена, приведенная в первой таблице, есть разность этих двух величин: 365 = 930 – 565.
Проведенное сопоставление подводит к представлению об энергии активации реакции. Мы увидели один возможный путь разложения ацетилена. Для его осуществления и, следовательно, для того чтобы получить энергию разложения 216 кДж/моль, нужно сперва затратить 565 кДж/моль на то, чтобы разложить одиночную молекулу ацетилена с образованием одиночной молекулы С2.
Отсюда можно было бы сделать вывод, что энергия активации распада ацетилена равна 565 кДж, скорость распада пропорциональна ехр(-144/(RT)). При этом ацетилен распадался бы за один год при температуре 4000 К и за одну секунду при 7000 К. Однако такое заключение было бы поспешным и неверным. Опыт показывает, что ацетилен быстро разлагается при гораздо более низкой температуре.
В числах, приведенных выше, нет арифметических ошибок. Но принципиальная ошибка состоит в том, что рассматривается только один путь реакции – тот, который первым приходит на ум, т.е. тот путь, который легко написать на бумаге. В действительности, в статистическом хаосе молекулярных столкновений и реакций осуществляются одновременно все варианты, и главную роль играют, естественно, те пути, на которых меньше энергия активации, т.е. пути более легкие.
Происходит природный, естественный отбор наподобие дарвиновского отбора в живой природе. Так появляются сложные, но целесообразные схемы химических реакций. Так природа естественно подводит нас к идее цепных реакций. Нужно воздать должное Η. Н. Семёнову, необычайно широко развившему теорию цепных химических реакций.
Вернемся к таблице энергий связи. Мы констатировали, что в таблице фигурируют только положительные величины. В чем причина этого факта? Является ли запрет на отрицательные величины абсолютным? Есть ли исключения?
Ответ заключается в том, что простая (состоящая из нескольких – двух, трех или четырех атомов) молекула с отрицательной энергией связи, как правило, распадается за время порядка одного периода колебания, т.е. 10-12 с. В редких случаях специальные причины, особенности электронной структуры молекулы могут увеличить это время в тысячу или в крайнем случае в миллион раз. Время распада станет равным 10-9–10-6 с. Но молекулы с таким временем жизни (даже при комнатной или при низкой температуре) нельзя синтезировать в значительном количестве. Классическая химия и химическая практика не рассматривают такие соединения. Поэтому в таблице нет соединений с отрицательной энергией связи.
Надо, однако, подчеркнуть, что категоричность высказываний уменьшается по мере того, как мы переходим к более сложным многоатомным молекулам. Молекула динитрогликоля C2H4(ONO2)2 распадается на части – молекулы N2, 2Н2O, 2СO2 – с выделением энергии. Именно поэтому динитрогликоль является взрывчатым веществом. Вместе с тем динитрогликоль достаточно стабилен при комнатной температуре. Достаточно посмотреть на структурную формулу динитрогликоля, чтобы понять причину его относительной стабильности:
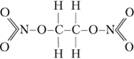
Распад па части этой молекулы в действительности является перегруппировкой атомов. В молекуле нет ни одной индивидуальной химической связи, разрыв которой был бы энергетически возможен. Лишь последующее установление новых связей (ΝºΝ, Н-О-Н, O=С=O) компенсирует, а точнее, перекомпенсирует разрыв связей, скрепляющих исходную молекулу. Неудивительна поэтому стабильность динитрогликоля. Скорее удивительна сравнительно малая теплота активации реакции распада.
Вернемся теперь к вопросу о теплоте реакции.
Чтобы рассчитать теплоту реакции, проводящейся в условиях, отличающихся от стандартных, нужно найти изменение теплосодержания при переходе к другим Р и Т.
Для идеальных газов теплоОГЛАВЛЕНИЕ не зависит от давления, а зависимость от температуры дается формулой (Я. Б. Зельдович, 1980)
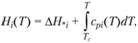 (3.29)
(3.29)
где cpi = (dHi/dT)p – теплоемкость i-го вещества при постоянном давлении. Поэтому теплота реакции, происходящей при температуре Т, равна
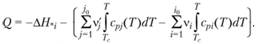 (3.30)
(3.30)
Часто при приближенных расчетах теплоты реакции теплоемкость считают величиной, не зависящей от температуры и равной некоторому среднему ее значению в интервале температур от Тс до Т, тогда теплоОГЛАВЛЕНИЕ смеси и теплота реакции являются линейными функциями температуры.
Между энергетическими характеристиками элементарного химического акта – тепловым эффектом и энергиями активации прямой и обратной реакций – существует простое соотношение. Его нагляднее всего пояснить на рис. 3.1, на котором представлена потенциальная энергия взаимодействия атомов, участвующих в реакции, как функция так называемой координаты реакции, характеризующей взаимное пространственное положение атомов. Начальный и конечный уровни энергии отличаются между собой на величину теплоты реакции (λ Экзотермическая реакция соответствует превышению начального уровня энергии над конечным, при эндотермической реакции энергия конечного состояния больше.
Переход из начального в конечное состояние связан с преодолением потенциального барьера – энергии Е для прямой реакции и E' – для обратной. Таким образом,
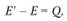 (3.31)
(3.31)
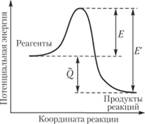
Рис. 3.1. Соотношение между энергетическими характеристиками элементарного акта химического превращения
Для экзотермической реакции E' > Е, т.е. скорость прямой реакции слабее зависит от температуры, чем скорость обратной. Для эндотермической реакции имеет место обратная ситуация.