Химические свойства. Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
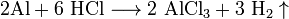
Взаимодействие с оксидами металлов с образованием растворимой соли и воды:

Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):

Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:

Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:

При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
4 HCl + O2 → 2 H2O +2 Cl2↑
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
2 Cu + 4 HCl → 2 H[CuCl2] + H2↑
Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту HSO3Cl:
SO3 + HCl → HSO3Cl