Тренажёр по теме: «Неметаллы» 9 класс
FeS2 à SO2à SO3à H2SO4à SO2à NaHSO3
N2à NH3à NO2à HNO3à Mg(NO3)2à O2
NaOH ® NaHCO3 ® Na2CO3 ® Na2SO4 ® NaCl ® Na
P ® P2O5 ® H3PO4 ® Na3PO4 ® Ca3(PO4)2;
NH3 (NH4)2SO4 ® NH4Cl ® NH3 ® NH4NO3;
FeS ® H2S ® KHS ® SO2 ® NaHSO3 ® CaS;
KBr ® Br2 ® HBr ® NaBr ® AgBr;
P Mg3P2 PH3 P2O5 H3PO4;
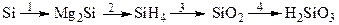
- Постройте структурные и электронно-графические формулы молекул оксидов неметаллов второго периода и их водородных соединений. Определите механизм образования химической связи.
- Приведите не менее пяти реакций характеризующих разнообразие химических свойств азотной, серной, угольной, соляной кислот. Назовите продукты.
- Какой объём водорода может быть получен при действии избытка соляной кислоты на
10 г. смеси железа с цинком, если массовая доля цинка в смеси равна 60%?
5. При пропускании аммиака через раствор серной кислоты массой 20 г. получено 6,6 г.
сульфата аммония. Определить массовую долю кислоты в исходном растворе.
6. Запишите формулы всех оксидов хлора с нечётными степенями окисления галогена.
Составьте уравнения реакции гидратации этих оксидов.
7. Приведите четыре способа получения бромида натрия.
8. Приведите примеры двух химических реакций, в которых образуется сера.
9. Приведите два уравнения реакции, в одном из которых простое вещество сера является
окислителем, а в другом – восстановителем.
10. В раствор соляной кислоты массой 170 г с массовой долей хлороводорода 22,5% поместили
гранулы алюминия массой 5,75 г. Вычислите объём выделившегося водорода и массовую
долю соли в полученном растворе.
11. Какой объём хлора необходим для полного вытеснения брома из 25 г технического бромида
натрия, содержащего 5% не реагирующих с хлором примесей?
12. Смесь массой 6 г, состоящую из алюминия и меди, обработали соляной кислотой и собрали
3,7 л водорода (н.у.). Определите массовые доли металлов в смеси.
13. Оксид натрия может прореагировать с 3,6 г воды. Какая масса оксида углерода (IV) может
прореагировать с такой же порцией оксида натрия?
14. Кальций массой 10 г сожгли в кислороде. Получившийся в ходе реакции оксид растворили в
соляной кислоте. Какова масса образовавшейся соли?
15. Какую массу известняка, содержащего 10 % примесей необходимо прокалить, чтобы
выделившегося газа хватило для образования 3,18 г соды (Na2CO3)?
16. Какой объём водорода (н.у.) образуется при растворении в соляной кислоте 5 г сплава
Деварда, в котором массовые доли меди 50 %, алюминия 45 %, цинка 5 %.
17. Выберите из списка схем окислительно-восстановительные реакции. Расставьте в них
коэффициенты методом электронного баланса:
а) FeO+ HCl FeCl2+ H2O; б) Fe+ HCl FeCl2+ H2;
в) Na+ H2O NaOH+ H2; г) Na2O+ H2O NaOH.
д) KMnO4 K2MnO4+ MnO2+ O2; е) MnO2+ HCl MnCl2+ Cl2+ H2O;
ж) NH3 + O2 NO + H2O; з) KNO2 + HCl KCl + NO2 + NO + H2O.