Типы электронных переходов
Как следует из литературы [1-3] различают молекулярные орбитали s и p-типа. Орбиты обоих типов могут быть связывающими s и p (с объединением атомов) и разрыхляющими (с разъединением атомов). Поглощение света сопровождается переходом со связывающей s или p орбитали на разрыхляющую (s* или p*). В связи с этим различают s-s* и p-p* переходы.
Не участвующие в образовании химических связей электроны неподеленных пар (например 2s2 у азота) образуют несвязывающие n-орбитали. Энергия неподеленной пары электронов в молекуле равна её энергии в изолированном атоме. Несвязываюшие n-орбитали локализованы на отдельных атомах, тогда как s и p- орбитали обычно распространяются на два или более атома в молекуле.
Как видно из рис. 1 уровень n несвязывающей орбитали расположен выше уровней связывающих s и p-орбиталей. В основном состоянии s , p и n орбитали обычно заняты электронами, а s* и p*-орбитали свободны. Поглощение света происходит в результате переходов с занятых орбиталей на свободные. Наибольшей энергии требует s-s* переход, характерный для насыщенных молекул и соответствующих поглощению в вакуумном УФ (l<200 нм). Переходы p-p* происходят в молекулах с сопряженными связями и в ароматических молекулах. Они связаны с поглощением в видимой области или ближнем УФ. Переходы n-s* и n-p* происходят в молекулах, содержащих гетероатомы (N, O, S и т.п.). Для биологических макромолекул типичны переходы в дальней УФ области спектра.
| E® | 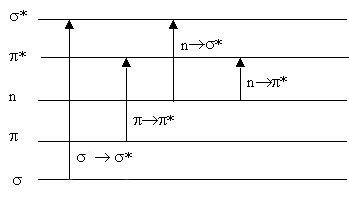
|
| Рис.1 Типы электронных переходов |