Тема: ПОВЕРХНЕВІ ЯВИЩА. ПОВЕРХНЕВИЙ НАТЯГ. ЗАЛЕЖНІСТЬ ПОВЕРХНЕВОГО НАТЯГУ РОЗЧИНІВ ВІД КОНЦЕНТРАЦІЇ ПАР
Мета. Дослідити вплив концентрації поверхнево-активної речовини на поверхневий натяг водних розчинів. Визначити молекулярні характеристики ПАР.
1. Поверхневі явища. Поверхневий натяг розчинів поверхнево активних речовин
Молекули в об¢ємі тіла рівномірно оточені такими ж молекулами, а тому силові поля повністю скомпенсовані. Молекули ж поверхневого шару взаємо-діють як з молекулами однієї фази, так і з молекулами іншої фази, завдяки чому рівнодійна молекулярних сил у поверхневому шарі не дорівнює нулю і спрямова-на в середину тієї фази, з якою взаємодія більша. Таким чином виникає поверхневий натяг s, який прагне зменшити поверхню. Його можна уявити як енергію перенесення молекул з об¢єму тіла на поверхню або ж як роботу утворення одиниці поверхні.
Величину s можна виразити як похідну енергії Гіббса dG за величиною міжфазної поверхні S:
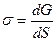 (1)
(1)
З цього випливає, що для індивідуальної речовини поверхневий натяг є енергією Гіббса, яка припадає на одиницю поверхні.
У випадку чистих рідин самочинне зменшення вільної поверхневої енергії реалізується за рахунок зменшення площі межі розділу фаз до мінімальної. Для розчинів двох і більше компонентів, існує інший шлях пониження вільної енергії – самочинний перерозподіл молекул в розчині, що приводить до зміни складу поверхневого шару порівняно із об’ємом. У поверхневому шарі відбувається зміна концентрації окремих компонентів, яка називається адсорбцією. Якщо відбувається збільшення концентрації компонента в поверхневому шарі порівняно із об’ємом, то така адсорбція позитивна. При зменшенні концентрації компонента в поверхневому шарі порівняно із об’ємом - адсорбція від’ємна. Речовини, спричинюючі позитивну адсорбцію називаються поверхнево-активними.
Кількісно процес адсорбції на межі розділу розчин-газ описується рівнянням Гіббса.
У теорії Гіббса адсорбція - це самочинна зміна концентрації компонентів системи у поверхневому шарі порівнянo з концентрацією в об¢ємі фази. Гіббс шляхом нескладних перетворень отримав рівняння для розрахунку адсорбції Г:
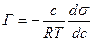 ; (2)
; (2)
де с - концентрація ПАР в об’ємі розчину; моль/л; R - універсальна газова стала; Т – температура досліду, К; ds/dc - похідна поверхневого натягу за концент-рацією, яка називається поверхневою активністю.
З рівняння (2) випливає, що Г>0, тобто концентрація розчиненої речовини в поверхневому шарі більша, ніж в об¢ємі розчину, якщо у випадку додавання цієї речовини ds/dc<0. Така закономірність спостерігається для речовин полярність яких менша, ніж полярність розчинника. Це означає, що в поверхневому шарі буде накопичуватись речовина, яка буде знижувати поверхневий натяг розчину, тобто поверхнево-активна речовина. У випадку додавання речовин, які є більш полярними ніж розчинник, поверхневий натяг збільшується (ds/dc>0), а значення Г<0, тобто концентрація більш полярного компонента в поверхневому шарі, менша ніж у розчині. Речовини, які, потрапляючи в розчин, зменшують поверхневий натяг, називаються поверхнево-активними. До них належать речовини, молекули яких мають дифільну природу, тобто, містять полярну групу (-СООН , -OH, -NH2, -NO2, -OSO3 та ін.) та неполярний вуглеводневий радикал. Речовини, які при внесенні в розчиник збільшують поверхневий натяг утвореного розчину на межі поділу фаз, називаються поверхнево-інактивними. До таких речовин відносяться мінеральні кислоти та їх солі – електроліти. Є цілий клас речовин, які є індеферентними – не впливають на значення поверхневого натягу утвореного розчину. Такі речовини містять багато функціональних груп в молекулі, наприклад, сахароза.