МИКРОБИОЦЕНОЗ КИШЕЧНИКА И ИММУНИТЕТ
ОГЛАВЛЕНИЕ
Микробиоценоз кишечника и иммунитет................................................................ 4
Общие принципы применения пробиотиков в педиатрии................................ 9
Показания к применению пробиотиков................................................................. 11
Классификация пробиотиков...................................................................................... 13
Тактика применения пробиотиков.......................................................................... 19
Сочетание пробиотиков с другими лекарственными препаратами
при нарушении микробиоценоза кишечника...................................................... 25
Пребиотики......................................................................................................................... 26
Ферментотерапия............................................................................................................. 27
Энтеросорбентная терапия........................................................................................... 28
Биологически активные добавки к пище (БАД)................................................. 28
Выбор и применение БАД............................................................................................. 30
МИКРОБИОЦЕНОЗ КИШЕЧНИКА И ИММУНИТЕТ
С современных позиций нормальную микрофлору кишечника (микробиоценоз) можно рассматривать как совокупность облигатных (индигенных) микроорганизмов, заселяющих пищеварительный тракт и обеспечивающих как неспецифический микробиологический, так и иммунологический барьер защиты от патогенных микробом и других экзогенных факторов агрессии.
К защитным функциям нормофлоры кишечника относятся стимуляция и стабилизация целостности эпителия кишечной стенки (цитомукопротекторный эффект), активное участие в дифференциации лимфатических органов желудочно-кишечного тракта и регуляция функции как местного (кишечного), так и гуморального иммунитета.
Желудочно-кишечный тракт является важным органом иммунитета и с этой точки зрения представляет особенный интерес. В иммунной системе ЖКТ можно выделить две зоны - индуктивную и эффекторную. Индуктивная зона состоит из пейеровых бляшек, аппендикса, регионарных лимфатических
узлов и обеспечивает распознавание, презентацию антигена и формирование популяции антигенспецифических Т- и В-лимфоцитов. Эффекторная зона состоит из собственной пластинки (Lamina propria) и эпителиальных клеток слизистойоболочки кишечника и обеспечивает синтез иммуноглобулинов В-лимфоцитами, цитокинов моноцитами/макрофагами, Т- и NK-лимфоцитами, то есть выполнение ими своих эффекторных функций.
Пейеровы бляшки — это субэпителиальные групповые лимфатические фолликулы, располагающиеся в тонкой и, прежде всего, в подвздошной кишке. Исследования последних лет подтвердили, что «знакомство» макроорганизма с антигеном происходит именно через эпителий пейеровой бляшки. Их количество у ребенка достигает более 200. В каждой пейеровой бляшке имеется куполообразный участок, эпителий которого не несет ворсинок и крипт, содержит небольшое количество бокаловидных клеток и специфические М-клетки, которые тесно контактируют с лимфоцитами и макрофагами. Главная роль М-клеток — захват и транспорт антигена внутрь пейеровых бляшек. В настоящее время установлено, что транспорт как растворимых, так и корпускулярных антигенов М-клетками является важнейшим фактором в индукции иммунного ответа лимфоидными клетками ЖКТ.
Особенностью иммунной системы кишечника является также то, что Т-лимфоциты, находящиеся между фолликулами, в куполе бляшки или в эпителии кишечной стенки, не обладают киллерными свойствами, а собственные В-лимфоциты не способны образовывать антитела. По данным М. Kagnoff (1980), В-клетки в 80% случаев являются носителями IgG и в активированном состоянии способны мигрировать из пейеровых бляшек в другие участки, в том числе в собственную пластинку (Lamina propria), где секретируются в основном IgA. Таким образом, главная функция пейеровых бляшек заключается в «вылавливании» антигена из просвета кишки. Кроме того, пейеровы бляшки
являются важным источником плазмоцитов, синтезирующих IgA практически для всех слизистых оболочек и железистых органов.
Другая особенность иммунной системы кишечника — лимфоциты, расположенные внутриэпителиально. Они составляют одну треть лимфоцитов, расположенных вне лимфоидной ткани, и в подавляющем большинстве представлены СБ8+-клетками (цитотоксические Т-лимфоциты), единичными
NK-клетками. В-лимфоциты полностью отсутствуют. В L. propria ситуация иная - здесь в основном сосредоточены СБ+-клетки (Т-хелперы), В-лимфоциты и плазматические клетки, способные к синтезу IgA, IgM и IgG в соотношении 20 : 3 : 1. Значение доступа антигенов через слизистую оболочку других участков, кроме пейеровых бляшек, у человека еще полностью не изучено, но, возможно, это наблюдается у пациентов с заболеваниями ЖКТ.
Формирование и функционирование иммунной системы организма происходит в два этапа. Первый этап - качественный и антигеннезависимый, развивается - в лимфоидной ткани, не связанной с ЖКТ, и заключается в формировании антигенспецифических клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в исходных гаметах в эмбриогенезе. Второй этап - количественный и антигензависимый - начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. В первые часы жизни ребенка лимфоидная ткань ЖКТ получает мощную стимуляцию заселяющейся микрофлорой, в результате чего быстро начинает нарастать количество интраэпителиальных имфоцитов и клеток, продуцирующих иммуноглобулины, как в лимфоидных фолликулах, так и в собственной пластинке и соответственно повышается концентрация сывороточных иммуноглобулинов. Лимфоидная ткань, ассоциированная с ЖКТ, в основном продуцирует IgA. При этом энтероциты играют важную роль в транспорте синтезированного IgA на поверхность слизистой оболочки кишечника, а затем в его секреторную жидкость в виде секреторного IgA. Существенная роль в этом процессе принадлежит нормальной микрофлоре кишечника. Таким образом, становление собственного кишечного иммунитета происходит в период ранней микробной колонизации кишечника и начинается сразу после рождения ребёнка.
В результате антигенной стимуляции микрофлорой кишечника в организме ребенка формируется и поддерживается общий пул иммуноглобулинов, а образующийся защитный слой, состоящий из слизи, секреторных IgA, IgM и микрофлоры, покрывает всю поверхность ворсин кишечника, препятствуя
механическому и химическому повреждению слизистой патогенными бактериями и токсинами. Установлено, что у безмикробных животных имеет место недоразвитие систем иммунитета, выражающееся снижением количества иммунокомпетентных клеток в лимфоидных тканях, угнетением клеточного звена иммунитета, а также повышением чувствительности к инфекциям. Экспериментально доказано, что пероральное введение убитых бифидо- и лактобактерий приводит к повышению устойчивости к сальмонеллезной инфекции, причем данный эффект сопровождается увеличением числа В-клеток в тонкой кишке.
Иммунобиологические взаимоотношения в системе «организм - индигенная флора» имеют огромное значение в поддержании здоровья в целом и в формировании иммунологической толерантности. Иммунная функция микрофлоры включает синтез факторов иммунной защиты лизоцима, пропердина комплемента, slgA, активацию фагоцитоза, стимуляцию системы цитокинов и интерферонов (С. Walker, 2000; A. Blum, 2002).
К сожалению, до настоящего времени физиологические особенности защитных систем организма детей, особенно у новорожденных и детей раннего возраста, не изучены. По данным Л.И. Кафарской с соавт., на протяжении относительно долгого времени после рождения .»тп системы остаются незрелыми, либо качественно наивными («необучаемыми»): у детей число IgA синтезирующих плазматических клеток слизистой оболочки приближается к норме взрослых лишь ко второму годужизни, а количество мукозных IgA - к 6-8 годам. По данным этих же авторов, созревание иммунной системы определяется контактами новорожденных с оактерпа м.ш.пип п пищевыми аллергенами, в том числе и при участии бактерии нормальной флоры кишечника, которые обладают иммуномодулирующими свойствами.
В исследованиях установлено, что бифидо- и лактобактерий оказывают выраженное иммуностимулирующее действие на систему местного иммунитета кишечника. В. breve, проявляя адъювантную активность, усиливают продукции антигенспецифичных IgA. Лактобактерий обладают способностью активировать клеточный иммунитет и подавлять продукцию IgE. Иммуномодулирующее действие лактобацилл в первую очередь связывают с присутствием в их клеточной стенке пептидогликанов и тейхоевых кислот, известных поликлональных индукторов и иммуномодуляторов.
Разные виды лактобактерий имеют существенные отличия в способности индуцировать секрецию цитокинов: L. casei служат мощным стимулятором продукции ИЛ-6, ИЛ-12, ФНО-альфа и экспрессируют маркеры созревания, тогда как L. reuteri являются слабым индуктором ИЛ-12 и подавляют секрецию
цитокинов и экспрессию маркеров созревания, вызванную другими видам лактобактерий.
Эшерихии коли в кишечнике человека также появляются в первые дни жизни после рождения и инициируют синтез секреторных IgA, поддерживая в физиологически активном состоянии местный иммунитет, и способствуют стимуляции системного гуморального иммунитета.
В последние годы обнаружена тесная связь между интестинальной колонизацией бактероидами и созреванием IgA- и IgM-секретирующих клеток в сравнении с колонизацией кишечника группами бактерий или вводимыми диетами. Установлено, что В. fragilis способны индуцировать развитие гуморального иммунного ответа — колонизация этими бактероидами сопровождалась повышением уровня IgA- и IgM- секретирующих клеток в периферической крови детей раннего возраста.
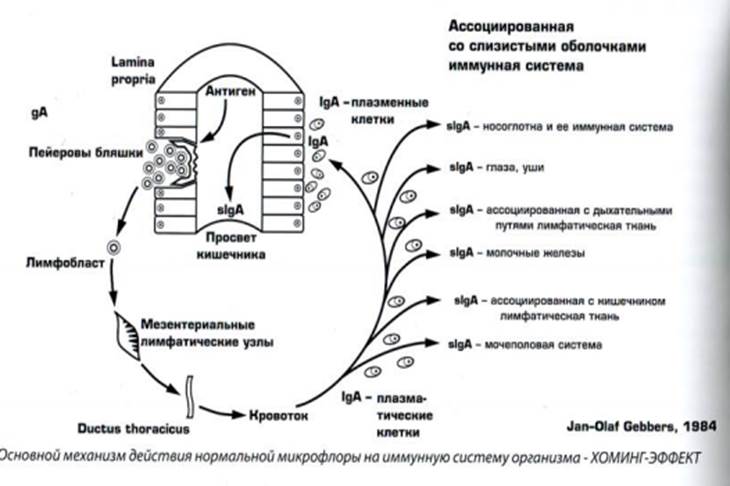
Представители нормальной микрофлоры кишечника (бифидо- и лактобактерий, энтерококки и др.) обладают высокими иммуногенными свойствами, проявляющимися прежде всего в поддержании концентрации секреторного IgA на слизистой оболочке, регуляции созревания лимфоидного аппарата кишечника, генерализации иммунного ответа. Такая взаимосвязь лежит в основе хоминг- эффекта (Jan-0laf Gebbers, 1984), заключающегося в рециркуляции лимфоцитов (рис. 1): сенсибилизированные индигенной микрофлорой лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения «целеустремленно» направляются к собственному слою кишечника, главным образом в качестве клеток, секретирующих IgA (Т. Tomasi и соавт., 1980).
Способность IgA взаимодействовать с секреторным компонентом позволяет всему комплексу транспортироваться через эпителиальные клетки кишечной стенки в полость кишки. Секреторные IgA cпособны связываться с патогенными микроорганизмами и другими антигенами и препятствовать их адгезии на эпителиоцитах кишечника. Дисбаланс в составе нормальной микрофлоры кишечника (дисбактериоз) может привести к нарушениям функционирования факторов местного иммунитета, создавая условия для внедрения патогенных и активации УПМ - возбудителей острых кишечных инфекций (ОКИ), с одной стороны, а с другой – иммунодефицитное состояние местного звена иммунитета – к количественным и качественным изменениям в кишечной микрофлоре и развитию дисбактериоза кишечника.
Основными механизмами, участвующими в контроле качественного и количественного состава и уровня бактерий в кишечнике, являются неспецефические и специфические факторы иммунологической защиты, созревание которых происходит под воздействием межмикробного взаимодействия бактерий нормальной микрофлоры. К иммунологическим механизмам относят интраэпителиальные и Lamina propria Т-лимфоциты (CD8 и CD4 соответственно), В- лимфоциты, ассоциированную с кишечником лимфоидную ткань, систему секреторных иммуноглобулинов (IgA) и иммуноглобулины других классов, систему IgE-мукозных тучных клеток [4].
В экспериментах установлено, что на уровне ЖКТ возможно селективное распознавание сигналов, исходящих от разных видов бактерий. То есть, для реализации разнообразных функций нормальной микрофлоры, в том числе и иммуномодулирующей, важным является сохранение стабильности качественных (видовых) и количественных соотношений между разными группами микроорганизмов. Например, на фоне снижения количества бифидобактерий повышается проницаемость эпителиального барьера кишечника и возникает дефицит секреторного IgA, который обладает способностью нейтрализовать УПМ и сапрофитных микроорганизмов, не затрагивая представителей нормальной микрофлоры. Одной из концепций, объясняющих такую толерантность, является активность супрессирующего фактора ТФР Ь. Полагают, что его функция связана с ослаблением провоспалительных стимулов, индуцируемых УПМ или патогенной микрофлорой.
В клинических исследованиях установлены выраженные тенденции к существованию сильной обратной связи между проявлениями дисбактериоза кишечника и нарушениями в системе иммунитета, а также связи выраженности клинической симптоматики с интенсивностью и структурой лабораторно подтвержденных нарушений в количественном и качественном составе микрофлоры и иммунном статусе. При изучении показателей гуморального иммунитета у больных с тяжелой формой дисбактериоза отмечено снижение концентраций в сыворотке крови IgA и IgG, фагоцитирующей активности лейкоцитов. Установлена коррелятивная связь между степенью дисбиотических нарушений и показателями секреторного компонента IgA. При дисбактериозе I и II степени отмечена активация механизмов местной защиты (повышение секреторного IgA, лизоцима в копрофильтратах), при дисбактериозе III степени выявлялось угасание этих реакций организма.
Учитывая выявленные корреляционные связи, очевидно, что целью пробиотической терапии в настоящее время является в первую очередь достижение иммунобиологического эффекта и оздоровления организма человека в целом.