Классификация методов осадительного титрования
Лекция
Осадительное титрование
Список рекомендуемых источников:
1. Васильев В.П. Аналитическая химия : В 2 кн. : Кн. 1 : Титриметрические и гравиметрические методы анализа : учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М. : Дрофа, 2004. – 368 с. (С. 274 – 280).
2. Лебедева М.И. Аналитическая химия и физико-химические методы анализа : учеб. пособие / М.И. Лебедева. – Тамбов : Изд-во Тамб. гос. техн. ун-та, 2005. – 216 с. – http://window.edu.ru/window_catalog/files/r38085/tstu2005-134.pdf
3. Основы аналитической химии : В 2 кн. : Кн. 2 : Общие вопросы. Методы разделения : учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М. : Высш. шк., 2000. – 494 с. (С. 96 – 101).
Осадительное титрование –это метод титриметрического анализа, основанный на применении титрантов, образующих с анализируемым веществом малорастворимые соединения.
Например,
Ag+ + I- AgI
Hg(NO3)2 + I- Hg2I2 + 2NO3-
3Zn2+ + 2K4[Fe(CN)6] K2Zn3[Fe(CN)6]2 +6K+
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются константой равновесия, так называемым произведением растворимости (ПР).
ПР – постоянная величина, равная произведению активностей ионов малорастворимого электролита в его насыщенном растворе.
Активность (a) –функция состояния вещества, являющаяся количественной характеристикой его реакционной способности в данных условиях:
a = f·c,
где f – коэффициент активности, который учитывает межионное взаимодействие и зависит от ионной силы раствора ().
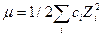 ,
,
где ci – концентрация i-го иона в растворе, Zi – заряд иона.
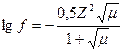
В сильно разбавленных растворах f = 1 и a = c.
Например,для AgCl (насыщенный раствор) имеем:

где aAg+ и aCl – активности соответствующих ионов; [Ag+] и [Cl] – равновесные концентрации тех же ионов, моль/дм3; fAg+и fCl – коэффициенты активности ионов.
В растворах малорастворимых веществ концентрации ионов малы и мало отличаются от активности ионов, коэффициенты активности близки к единице, следовательно, ПР(AgCl) можно записать в виде следующего выражения:
ПР(AgCl) = [Ag+][Cl-]
В общем виде для малорастворимого электролита AaBb:
ПР(AaBb) = [Aa][Bb]
Величины ПРданы в справочных таблицах.
Для сравнения растворимости осадков пользуются не величинами ПР, а растворимостью, которая равна равновесной концентрации ионов в растворе над осадком.
Для электролитов типа AB растворимость:
S, моль/дм3 = 
Растворимость малорастворимого соединения состава AaBb равна:

Требования, предъявляемые к реакциям осаждения в осадительном титровании:
1. Анализируемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и содержать хотя бы один ион, вступающий в реакцию осаждения с титрантом.
2. Реакции осаждения должны протекать строго стехиометрически; побочные реакции и реакции соосаждения исключаются.
3. Реакция должно протекать практически до конца (99,99%); осадительное титрование следует применять, если ПР:
– бинарного осадка состава KtAn < 108;
– осадка состава Kt2An и KtAn2 < 1012.
4. Реакция должна протекать быстро, при комнатной температуре, без образования пересыщенных растворов.
5. Наличие индикатора, позволяющего фиксировать конец реакции.
Реакции осаждения при использовании в титриметрическом методе анализе обладают рядом недостатков:
– процесс осаждения обратим;
– небольшая скорость многих реакций осаждения;
– при образовании осадка определяемого вещества происходят процессы соосаждения, адсорбции, образования коллоидов.
Условия образования и растворения осадков:
Осадок выпадает из пересыщенного раствора, т.е. если произведение концентрации ионов, способных образовывать малорастворимое вещество,больше величины ПРданного вещества.
Если жепроизведение концентраций ионов меньше величины ПР, то осадок не образуется, а при внесении в такой раствор твердого вещества будет наблюдаться его растворение.
На растворимость осадков влияют ряд факторов:
· действие одноименного иона, выражающееся в резком понижении растворимости. Увеличение концентрации этих ионов в растворе может быть обусловлено добавлением избытка осадителя. Так, растворимость AgCl при избытке Cl – ионов составит:

· влияние соли, не имеющей одноименных ионов, приводит к повышению растворимости. Этот так называемый солевой эффект, который связан с увеличением ионной силы раствора вследствие введения в него других ионов. Влияние будет различным и будет зависеть от природы добавленной соли, так как ионная сила зависит от величины зарядов ионов.
При образовании осадков малорастворимых соединений существует определенная последовательность, которая связана с их ПР: первым выпадает в осадок вещество с меньшим значением ПР.
Например, если в растворе присутствуют Cl , Br , I-ионы, то при осаждении их в виде галогенидов серебра первым осаждается иодид, затем бромид и, наконец, хлорид серебра. Это определяется сопоставлением значений ПР этих соединений:
ПР(AgCl) = 1,70·10-10, ПР(AgBr) = 7,70·10-13, ПР(AgI) = 1,50·10-16.
Классификация методов осадительного титрования
Методы осадительного титрования классифицируют по типу титранта:
– AgNO3 – аргентометрия;
– Hg2(NO3)2 – меркурометрия;
– Hg(NO3)2 – меркуриметрия;
– H2SO4 – сульфатометрия;
– BaCl2 – бариметрия
– и т.д.
Следует отметить, что осадительные методы имеют ограниченное значение. Ограничение связано главным образом с неколичественным и нестехиометрическим протеканием реакций. Учитывая это, широкое применение получили аргентометрия (осаждение нитратом серебра) и меркурометрия (осаждение нитратом ртути (I)).
Аргентометрия
Применяют для определения главным образом галогенидов, спиротовых растворов I2, барбитуратов при анализе фермпрепаратов. При этом образуются малорастворимые соли серебра.
Основными рабочими растворами являются растворы нитрата серебра, хлорида натрия и тиоцианата калия или аммония. Хранят раствор AgNO3 в склянках из темного стекла, т.к. на свету соли серебра неустойчивы. Точную концентрацию раствора AgNO3 обычно устанавливают по NaCl.
Растворы NaCl и KSCN (или NH4SCN) готовят из перекристаллизованных препаратов. Точную концентрацию KSCN (или NH4SCN) устанавливают по титрованному раствору AgNO3.
Для установления точки эквивалентности используют различные методы:
Ø Метод Гей-Люссака (метод равного помутнения) (1832). При титровании хлорида вблизи ТЭ отбирают небольшие порции прозрачного раствора и добавляют к одной порции AgNO3, а к другой NaCl. Если достигнута ТЭ, помутнение в обеих порциях будет одинаковым. В недотитрованных растворах помутнение будет происходит только при добавлении AgNO3, а в перетитрованных – при добавлении NaCl. Метод характеризуется высокой точностью. Но в настоящее время не применяется.
Ø Метод Мора (1856). Титрование галогенид-ионов (Cl, Br, I) проводят стандартным раствором AgNO3 в присутствии осадительного индикатора K2CrO4 при pH = 6,5 – 10,3 , так как в кислой среде
CrO42- Cr2O72-
а в сильнощелочной среде титрование невозможно, так как
2Ag+ + 2OH- 2AgOH Ag2O + H2O
коричневый
Так как растворимость
AgCl 105 моль/дм3; AgBr 5 · 107 моль/дм3; AgI 9 · 109 моль/дм3,
а растворимость
Ag2CrO4 =  моль/дм3,
моль/дм3,
то сначала осаждаются Г--ионы, и лишь после из осаждения образуется оранжево-красный осадок Ag2CrO4 . ТЭ наблюдают по образованию красного окрашивания, вызываемого Ag2CrO4 .
Метод Мора обычно применяют для определения хлоридов и бромидов. Иодиды и тиоцианаты не определяются, т.к. вследствие адсорбции установление ТЭ становится затруднительным и погрешность анализа существенно возрастает.
Ø Метод Фольгарда (1870). Реакцию взаимодействия серебра с тиоцианатом используют для определения галогенидов методом обратного титрования. Титрование проводят в присутствии Fe3+-ионов в кислой среде (pH < 1) для предотвращения гидролиза соли железа(III), используемой в качестве так называемого металлохромного индикатора ((NH4)2SO4·Fe2(SO4)3·24H2O – железоаммонийные квасцы). Продукты гидролиза этой соли окрашены.
К анализируемому раствору, содержащему Г-ионы, добавляют избыток стандартного раствора AgNO3, который потом оттитровывают стандартным раствором NH4SCN в присутствии Fe3+-ионов.
До ТЭ протекает реакция Ag+ + Г AgГ .
После ТЭ лишняя капля NH4SCN вызывает появление кроваво-красного окрашивания Fe(SCN)3 .
По методу Фольгарда могут быть оттитрованы и другие анионы, образующие малорастворимые соединения с ионом Ag+ (С2О42-, РО43-, S2- и т.д.).
Ø Метод Фаянса (1923). Основан на применении так называемых адсорбционных индикаторов – органических веществ, которые адсорбируются осадком в ТЭ и окрашивают его, а до ТЭ не адсорбируются.
В первую очередь на осадке адсорбируются ионы, одноименные с осадком. Например, при титровании хлорида нитратом серебра на осадке AgCl до точки эквивалентности будут адсорбироваться преимущественно хлорид-ионы С1- и для нейтрализации отрицательного заряда к частицам осадка будут притягиваться положительно заряженные ионы из раствора. После точки эквивалентности адсорбироваться на осадке будут избыточные ионы Ag+ и для нейтрализации уже положительного заряда осадка из раствора будут притягиваться отрицательно заряженные ионы, в том числе анионы индикатора. Анионы некоторых красителей, адсорбируясь, изменяют свой цвет.
Отличным адсорбционным индикатором для титрования хлора является флуоресцеин, имеющий в растворе желто-зеленую окраску, а в ТЭ окрашивающий осадок AgCl в красный цвет. Титрование с флуоресцеином происходит при рН 7 – 10, поскольку индикатор является слабой кислотой.
Эозин успешно применяется для титрования бромида, иодида и тиоцианата при рН 2, поскольку он является довольно сильной кислотой.
Известны также адсорбционные индикаторы-катионы, адсорбирующиеся на отрицательно заряженных осадках. Одним из таких индикаторов является родамин 6G.
Титрование с адсорбционными индикаторами в оптимальных условиях характеризуется высокой точностью и надежностью.
Меркурометрия
Меркурометрические методы основаны на образовании малорастворимых соединений ртути (I) с галогенидами и некоторыми другими анионами:
Hg22+ + 2Х- = Hg2X2
Титрантом в меркурометрии является раствор нитрата ртути (I), который готовят из препарата Hg2(NO3)2 • 2Н2О и устанавливают титр по NaCl или NaBr.
В качестве индикаторов применяют тиоцианатные комплексы железа (Ш) или дифенилкарбазон.
Применение первого индикатора основано на обесцвечивании раствора тиоцианатных комплексов железа (Ш) под действием иона Hg22+, образующего осадок Hg2(SCN)2:
2FeSCN2+ + Hg22+ = Hg2(SCN)2 + 2Fe3+
Малорастворимый Hg2(SCN)2 образуется параллельно с Hg2Cl2, и обесцвечивание раствора происходит в области скачка титрования. Объем рабочего раствора Hg2(NO3)2, израсходованный на реакцию с индикатором, устанавливается проведением холостого опыта.
Дифенилкарбазон можно рассматривать как адсорбционный индикатор, в ТЭ окрашивающий суспензию Hg2Cl2 в ярко-голубой или сине-фиолетовый цвет. Титрование с дифенилкарбазоном проводится в сильнокислой среде, что является существенным достоинством метода.
В качестве цветных индикаторов могут быть использованы также бромфеноловый синий, бромкрезоловый пурпурный и др.
Меркурометрический метод применяют для определения хлоридов и бромидов. Титрование может проводиться в разбавленных (0,01 М) растворах. При таких же низких концентрациях титруются и иодиды.
Кривые титрования
Кривые титрования обычно строят в координатах pAg – V (для аргентометрии), где pAg – взятый с обратным знаком логарифм концентрации ионов Ag+, V – объем титранта.
Рассчитаем кривую титрования 100,0 мл 0,10 н. раствора NaCl раствором 0,10 н. AgNO3, принимая для простоты расчетов, что объем раствора при титровании не изменяется и разница между активностью и концентрацией ионов несущественна.
В водном растворе NaCl диссоциирован нацело, поэтому концентрация Cl- в начальной точке кривой титрования, когда титрант не добавлялся, равна концентрации NaCl, т.е. 0,10 моль/л и pCl = 1,00.
Добавление раствора AgNO3 к NaCl вызовет образование осадка AgCl, и конценрация Cl- в растворе уменьшится.
Расчет pCl в процессе титрования представлен выглядит следующим образом:

На основании этих данных строят кривую осадительного титрования:

Кривая осадительного титрования раствора хлорида натрия стандартным раствором нитрата серебра
Рассчитанная кривая несколько отличается от реальной кривой осадительного титрования в силу допущений, принятых при расчетах (например, из-за пренебрежения растворимостью осадка вблизи ТЭ и изменением ионной силы раствора). Однако, соответствующие различия между рассчитанной и реальной кривой осадительного титрования незначительны и непринципиальны; рассчитанная кривая титрования в целом правильно отражает характер реальной кривой титрования.
Растворимость осадка, образующегося в процессе осадительного титрования, сильно влияет на протяженность скачка титрования. Чем ниже растворимость осадка (чем меньше его произведение растворимости), тем больше скачок на кривой.
Например, сравним, например, скачки на кривых осадительного титрования 0,1 моль/дм3 растворов KCl, KBr, KI раствором AgNO3 той же концентрации. При титровании образуются осадки галогенидов серебра AgГ (Г– – галогенид-ион) с различной растворимостью:

Рассчитанные величины скачка титрования увеличиваются при переходе от наиболее растворимого хлорида серебра к наименее растворимому иодиду серебра, что иллюстрируется кривыми титрования:

Сравнение кривых титрования 0,1 н. растворов KCl, KBr, KI 0,1 н. раствором нитрата серебра
Анализ кривой титрования:
1. Кривая симметрична относительно точки эквивалентности.
2. Скачок титрования ( 3.8 – 6.2). Он зависит от:
– концентрации реагентов: чем меньше концентрация, тем меньше скачок титрования;
– растворимости осадка: чем меньше растворимость, тем больше скачок(у AgI больше, чем у AgCl );
– температуры: чем больше температура, тем меньше скачок титрования, так как с повышением температуры растворимость, как правило, увеличивается.