ГЛАВА 1 ГАЗОВА КОРОЗІЯ МЕТАЛІВ 1 страница
Чатина 1
Основи теорії корозії металів
ГЛАВА 1 ГАЗОВА КОРОЗІЯ МЕТАЛІВ
1.1. Загальна характеристика процесів газової корозії
Газова корозія протікає при контакті металів з газами у відсутності електропровідних розчинів. У природних умовах газова корозія зустрічається рідко, а в технологічних процесах, особливо на металургійних та хімічених виробництвах, - досить часто. Як правило, газова корозія протікає по хімічному механізму.
Хімічна корозія металів - це самовільний окисно - відновний процес, який підпорядковується законам гетерогенних хімічних реакцій, які проходять одночасно в одному акті в точці взаємодії металу з компонентом агресивного середовища. Метал в процесі хімічної корозії виступає в ролі відновника, він віддає електрони і окислюється. Компонент агресивного середовища виступає в ролі окислювача, акцептора електронів. В процесі реакції він відновлюється. У ролі окислювачів можуть бути О2, CL2, НСL, SО2, СО2 і т.д.
Приклад. У промисловості синтез хлористого водню з хлору і водню здійснюють при температурі 1000-1200 °С. Якщо при цьому застосовують металеві печі, то внутрішня поверхня печей схильна до газової корозії. Залежно від вмісту хлору та водню в суміші газів протікають реакції:
Fe + CL2 = FeCL2
або
2Fe + 3CL2 = 2FeCL3.
Залізо виступає в якості відновника, хлор - окислювача, а на поверхні металу утворюється сольова плівка. Найбільш часто хімічний механізм реалізується в процесах газової корозії і в рідкому середовищі неелектролітів. Для більшості процесів основною умовою здійснення хімічної корозії є відсутність на поверхні металу плівки води. Ця вимога може бути досягнуто при дотриманні однієї з трьох умов:
• гази, що реагують містять мінімальну кількість вологи (як правило, не більше сотих часток відсотка);
• контакт металу і газів здійснюється при високих температурах, що перевищують «точку роси», коли конденсація вологи на поверхні металу не відбувається;
• метал знаходиться в середовищі неполярних органічних сполук.
У технологічних процесах часто вводять стадію осушки газів для зниження їх корозійної активності. Приклад. Вологий хлор є коррозіонноактівной середовищем. У ньому стійки тільки титан або графітові матеріали. Тому заключній стадією виробництва хлору є осушення газу сірчаною кислотою, що дозволяє знизити вміст вологи до 0,003-0,04%. При дотриманні цих умов швидкість корозії різко знижується і можливе застосування сталевої апаратури і трубопроводів. Аналогічну операцію проводять при отриманні брому, знижуючи на останніх стадіях процесу вміст вологи до 0,003-0,01%. Академік П.А. Ребіндер класифікував форми зв'язку води з матеріалом в залежності від енергії зв'язку. Вода в адсорбційних шарах (фізико-хімічний зв'язок) відрізняється від вільної води як за хімічними, так і по термодинамічних властивостях. Діелектрична постійна адсорбованої води в 40 разів менше, ніж у вільної води, а температура замерзання на кілька десятків градусів нижче. Припускають, що при контакті металу з газами, що містять до 0,05% Н2О, на поверхні металу знаходиться тільки фізико-хімічно зв'язана вода. Область існування високотемпературної газової корозії визначається інтервалом температур. Нижня межа відповідає температурі конденсації пари на поверхні металу. Це стан, який називається «точкою роси», залежить від парціального тиску парів води. Для повітря при атмосферному тиску вона оцінюється температурою, рівної 240-250 °С, а для газів, що відходять теплоелектростанцій - 90-100 °С. При температурах, що перевищують «точку роси», починається область хімічної газової корозії. Верхня температурна межа визначається такими властивостями металу, як жаростійкість і жароміцність. Жаростійкість характеризує здатність металу чинити опір корозійному впливу газів при високій температурі. Жароміцність визначає здатність матеріалу в умовах високотемпературного впливу зберігати хороші механічні властивості, тривалу міцність і опір повзучості. Метал може бути жаростоек, але не жароміцний, і навпаки - жароміцний, але не жаростоек. Так, наприклад, жароміцні сталі на основі заліза можна експлуатувати при температурах до 700 ° С, алюмінієві та мідні сплави - до 400-450 ° С, свинець - до 150 ° С. Ефективне поєднання жароміцності і жаростійкості досягається в сплавах системи нікель-хром - до 1000 °С. Високотемпературне взаємодія металів з окислювальним середовищем має місце при багатьох хімічних процесах.
Приклади. При виробництві сірчаної кислоти стадія випалювання серосодержащего сировини протікає при 700-800 °С, а контактна окислювання діоксиду сірки SО2 при 420-550 °С. При отриманні азотвмісних сполук конверсія метану СН4 здійснюється при температурі 700-800 °С, синтез аміаку NН3 при тиску 35-40 МПа і 400 °С, окислення аміаку при виробництві азотної кислоти при 750-800 °С, синтез хлористого водню НСL при 1000-1200 °С, хлорування метану при 400-450 °С, отримання метилового спирту СН3ОН при 375-400 °С, крекінг нафтопродуктів вище 450 °С. В усіх наведених прикладах поверхню апаратів піддається впливу агресивного газового середовища, що має призвести до утворення на металі оксидних або сольових сполук.
1.2. Структура металів і її вплив на корозійні процеси
Механізм утворення поверхневих сполук, їх адгезія до металу і властивості впливають на процес корозії. У свою чергу ці показники багато в чому визначаються структурою і складом металу. Більшість металів за винятком металевих стекол мають кристалічну структуру. У вузлах кристалічної решітки розташовані позитивно заряджені іони, а електрони вільно переміщуються в металі.
Найменша частина просторової решітки, якій притаманні всі властивості симетрії решітки в цілому, називається елементарною граткою. Якщо цей осередок є кубом, то і відповідна їй гратка буде кубічною. Простою кубічною граткою називається така решітка, у якої атомами або іонами зайняті лише вершини її елементарних осередків. Такий тип решітки мають, наприклад, кристалі кухонної солі NaСL. Грати, у якій крім вершин атомом або іоном зайнятий центр, називається об'емноцентрованою. Таку кристалічну будову мають літій, натрій, калій, ванадій, хром, залізо (при температурах до 900 °С). Гранецентрованою називається така решітка, у якої матермальнимі частками зайняті центри граней. Такий тип кристалічної решітки мають алюміній, нікель, мідь, свинець, срібло, золото, платина, залізо (в інтервалі температур 900-1400°С). Гексагональна решітка має в основі шестикутник. За таким принципом кристалізуються берилій, марганець, кадмій, титан і ін. Розрізняють також щільноупаковані кристалографічні площини і грати.
У ряді випадків кристалографічна структура визначає корозійну стійкість металів і їхніх сплавів. Реальні металеві матеріали, як правило, є полікристалічними, тобто складаються з безлічі окремих кристалів, які в загальному випадку мають неправильну форму і називаються кристалітів або зернами. На відміну від ідеальних кристалів, в яких атоми кристалічної решітки розташовані строго періодично, реальні кристалі завжди мають порушення регулярності структури (разупорядоченності), які називаються дефектами. Основними причинами відсутності у реальних конструкційних металевих матеріалів ідеального кристалічного стану є нерівноважні умови кристалізації металу, присутність в його складі легуючих і домішкових елементів, деформація кристалічної решітки внаслідок впливу на неї в процесі виготовлення виробів механічних, термічних, радіаційних та інших факторів. В даний час існує декілька способів класифікації дефектів металевих конструкційних матеріалів:
• за морфологічними ознаками - зовнішні, внутрішні, впровадження та ін;
• за походженням (генетичними ознаками) - ливарні, зварювальні, термічні, деформаційні, корозійні та ін;
• за структурними ознаками - тріщини, пори, надлишкові фази, неметалеві включення, межі зерен і др;
• на геометричні розміри-макро-(> 1 мм), мікро-(~ 200-1000 мкм) і субмікро-(~ 0,1-200 мкм) дефекти;
• по геометричних ознаками - точкові, лінійні, двомірні.
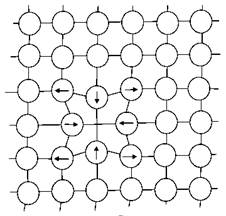
Дефекти кристалічних решіток змінюють задані властивості металів, впливають на його хімічні і електрохімічні характеристики. Дефекти структури, що виходять на поверхню металу, мають підвищену реакційною здатністю і вони є першими осередками корозії. Сторонні домішки концентруються у лінійних дислокацій і дірок на межі зерен. Ці сегрегації можуть збільшувати окислення металу, полегшувати утворення піттінгів. Будь-який вид неоднорідності підсилює як хімічну, так і електрохімічну корозію. Існує чотири основні типи точкових дефектів - вакансії, домішкові атоми заміщення і впровадження, дислоковані атоми, дефекти Френкеля. Вакансії (рис. 1.1, а) є найбільш часто зустрічаються точковими дефектами і являють собою вільні вузли в кристалічній решітці.
 а
а
|  б
б
|
 в
в
|  г
г
|
Рисунок 1.1. Точкові дефекти в кристалах:
а - вакансія; б - дислокований атом; в - дефект Френкеля; г - домішкові атоми впровадження. Стрілками указані напрямки зміщення атомів в кристалічній решітці.
Утворенню вакансій, в першу чергу, сприяють теплові коливання атомів. Вакансії виникають також при впливі на метал механічних напруг, радіоактивного випромінювання та ін При утворенні вакансій кристалічна решітка спотворюється, і найближчі до неї сусідні атоми зміщуються від свого рівноважного стану. Наприклад, для металів з гранецентрваними кубічними (ГЦК) гратами такий зсув для найближчих сусідніх атомів становить 0,84% міжатомної відстані (в сторону вакансії), для другого шару атомів - 0,25% (у бік від вакансії), для третього шару - 0,03% (у бік вакансії). Технічно чисті метали, до яких відносяться конструкційні матеріали, завжди містять в структурі домішкові атоми впровадження та / або заміщення (рис. 1.1, г), що є дефектами не тільки фізичної, але і хімічної природи. Домішкові атоми завжди розташовуються у вузлах кристалічної решітки, заміщуючи атоми основного металу. Домішкові атоми впровадження розташовуються в міжвузлях кристалічної решітки (рис. 1.1, г). При утворенні сплавів атоми впровадження з'являються в тому випадку, якщо відношення атомних діаметрів розчиненого і основного металів не перевищує 0,59. До схожих дефектів відносяться дислоковані атоми (рис. 1.1, б) - атоми основного металу, зміщені зі своїх рівноважних положень у міжвузольний простір. Переважними місцями розташування дислокованих атомів є порожнечі найбільшого обсягу, оскільки в цьому разі спотворення решітки будуть мінімальні. Утворення вакансій і дислокованих атомів може відбуватися одночасно. У цьому випадку утворюються парні дефекти, звані дефектами Френкеля (рис. 1.1 в). Енергія, необхідна для їх утворення, істотно вище, ніж енергія, необхідна для утворення індивідуальних вакансій або дислокованих атомів, внаслідок чого концентрація дефектів Френкеля в металевих матеріалах набагато нижче, ніж інших точкових дефектів. Точкові дефекти грають істотну роль у процесах дифузії іонів металу при утворенні поверхневих оксидних плівок. При легуванні іони легуючого компонента можуть входити в грати основного металу, утворюючи тверді розчини заміщення або витіснення. Лінійними (одновимірними) дефектами кристалічної решітки є дислокації. Дислокації виникають як в процесі затвердіння охолоджуваного металу, так і при механічних або інших впливах на метал. У конструкційних матеріалах дислокації утворюють суцільні сітки. Залежно від умов виготовлення металевих виробів щільність дислокацій в них може змінюватися від 103-104 см–2 (у добре відпалених матеріалах) до 109-1010 см–2 (у пластично деформованих матеріалах). Середня щільність дислокацій в полікристалічних матеріалах складає 106-108 см–2.
 а
а
|  б
б
|
 в
в
| |
 г
г
|
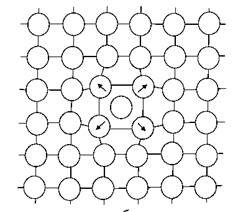
Рисунок 1.2. Будова границь в просторовій кубічній решітці:
а - границя скручування; б – двійник з когерентною границею; в, г - границі зерен, що розорієнтовані під великим кутом (г - загальний вигляд).
У реальних металевих матеріалах кількість дислокацій така, що вони утворюють суцільну тривимірну сітку з вузлами, в яких відбувається перетин окремих дислокацій. Відстань між вузлами сітки дислокацій оцінюється як ~ 10–4 см. До площинних і поверхневих дефектів кристалічної решітки (рис. 1.2 та 2.3) відносяться кордони, що розділяють різноорієнтовані області - межі зерен (рис. 1.2, а, в, г), блоків (разоріентірованних під малими кутами областей одного зерна, рис. 1.3, б), двійників (кристалів, решітки яких є дзеркальним відображенням один одного, рис. 1.2, б), а також межі, що розділяють ділянки решітки з різною упаковкою атомних шарів. Типи кордонів розрізняються кутом розорієнтування Ω (рис. 1.3, а). Величина Ω для блоків зазвичай становить 0,01 рад (~ 1°), для зерен ця величина може досягати десятків градусів. У цьому випадку межі представляють собою широкі смуги порушення кристалічної структури, що забезпечують плавний перехід від однієї орієнтації решітки до іншої. Чим більше величина Ω, тим вище енергія кристалічної решітки. У всіх випадках енергія грати, що містить поверхневі дефекти, више, ніж утієї, що містить лінійні дефекти. Границі, всі атоми яких одночасно належать обом кристалам (зернам), що стикаються називаються когерентнми (рис. 1.2, б), в іншому випадку границя є некогерентною. Дефекти кристалічної рещітки сприяють протіканню в металі процесів дифузії і фазових перетворень. Так, наприклад, добре відомий вакансійний механізм дифузії, коли атоми легуючих або домішкових елементів перерозподіляються в металі внаслідок послідовного переміщення у вакантні вузли. Взаємодія дефектів, приводить до зниження енергії кристалічної решітки. Це явищеє поширеним для металічних матеріалів.

а б
Рисунок 1.3. Утворення границі з малим кутом:
а – розташування двох кристалів з кутом розорієнтування Ω; б - границя з малим кутом.
Основна частина металевих конструкційних матеріалів проводиться шляхом виплавки, технології здійснення якої багатоступінчасті і визначаються необхідними властивостями отриманого матеріалу. Спільною рисою процесів виплавки металів і сплавів є нагрівання рудних матеріалів і напівфабрикатів до високих температур, що перевищують температуру плавлення найбільш тугоплавкого компонента, і наступне охолодження до температури затвердіння і далі до кімнатної температури. Залежність температур плавлення елементів від їх номера в періодичній системі Менделєєва наведена на рис. 1.4. Процес затвердіння рідкого металу супроводжується зміною його агрегатного стану з рідкого на тверде. Структура ближнього порядку, коли впорядковане розташування атомів поширюється тільки на найбільш близьких сусідів (характерно для рідких тіл чи твердих тіл, що знаходяться в аморфному стані), змінюється при цьому на структуру далекого порядку, коли практично у всьому обсязі матеріалу дотримується регулярне розташування атомів (характерно для кристалічних твердих тіл). Об’єм тіла при його затвердінні зменшується на 2 - 6 %, що є наслідком зменшення міжатомних відстаней. Ефект тим більше, чим більш компактна решітка характерна для затверділого металу. Внаслідок зменшення об'єму металу при його затвердінні в структурі реального злитка, як правило, присутні макродефекти - тріщини, раковини, порожнини. Крім макродефектів затверділий метал містить велику кількість мікродефектів - вакансій, дислокацій, дефектів, меж розділення. Будь-який вид неоднорідності, як то по складу, наявності домішок, центрів залишкової напруги, електропровідності окремих ділянок, призводить до збільшення швидкості корозії. Для того, щоб усунути або зменшити ці явища, проводять такі технологічні операції як загартування, відпал та ін. У переважній більшості металеві конструкційні матеріали є багатокомпонентними сплавами, до складу яких входять легуючі (вводяться спеціально для додання матеріалу необхідних властивостей) і домішкові (потрапляють в матеріал з рудними матеріалами в процесі виплавки і металургійних переділів) елементи. Вступаючи один з одним у взаємодію компоненти сплавів можуть утворювати фази - однорідні за структурою (кристалічному будові) та складом (концентрації компонентів) області, обмежені поверхнями розділу. Конструкційні матеріали, як правило, містять декілька фаз, відносна кількість яких може істотно відрізнятися.
1.3. Основи термодинаміки процесів корозії металів
Багато реакцій, що протікають при корозії, є оборотними. Закони термодинаміки дають можливість визначити ймовірність утворення з'єднання в тих чи інших умовах. На цілеспрямованому зсуві рівноваги заснований один з методів захисту металів від газової корозії - створення захисних атмосфер. Для визначення стану речовини в термодинаміці використовують такі поняття, як внутрішня енергія (U), ентальпія (Н), ентропія (S), ізобарно-ізотермічний потенціал (G), хімічний потенціал (μ). Зміна внутрішньої енергії в процесі пов'язане з кількістю виділеної теплоти (Q) і величиною виконаної системою роботи (А):
ΔU = Q – A. (1.1)

Порядковий номер елемента в таблиці Мендєлєєва
Рисунок 1.4. Залежність температур плавлення елементів від їх номеру в періодичній системі Мендєлєєва.
У випадку проходження хімічної реакції, що протікає при постійному об’ємі системи, зміна внутрішньої енергії дорівнює взятому з оберненим знаком тепловому ефекту реакції. Енергія речовини при постійному тиску характеризується ентальпією (Н). Остання більше внутрішньої енергії на величину роботи, яку може зробити система при постійному тиску:
Н = U + PV. (1.2)
При постійному тиску і за умови, що в ході процесу здійснюється тільки робота розширення
A = PΔV, (1.3)
або
ΔH = ΔU + PΔV. (1.4)
Порівнюючи рівняння (1.1) та (1.2) бачимо, що:
ΔНр = – Q, (1.5)
де ΔНр - ентальпія при постійному тиску.
Рівновага пов'язанa не тільки з різницею в енергії молекул, а й з імовірністю станів вихідних речовин і продуктів реакції, з можливістю протікання реакцій. Величина, яка дозволяє кількісно визначити ймовірність стану, називається ентропією, її зміна позначається ΔS, а розмірність - Дж /(моль∙град.). У хімічних реакціях, що йдуть при постійному тиску, одночасно змінюються і ентальпія і ентропія, а процес протікає в напрямку, при якому зменшується загальна рушійна сила реакції. Рушійна сила називається вільною енергією або ізобаричний потенціалом (ΔG). За міжнародною угодою 1961p. ізобарний потенціал названий «Bільною енергією Гіббса». Його розмірність - Дж / моль. Ізобаричний потенціал є властивістю речовини, що виражає одночасно як його ентальпію (енергію), так і властиву йому ентропію (ступінь безладдя).
Основне рівняння термодинаміки, що пвязує ці величини, має наступний вигляд:
ΔG = ΔH – TΔS. (1.6)
Ізобаричний потенціал пов'язаний з константою рівноваги простим співвідношенням:
ΔG = – RTlnK. (1.7)
Як приклад розглянемо реакцію окислення металу:
Ме + О2  МеО2
МеО2
У газовій атмосфері, що містить кисень, рівняння для ізобарно-ізотермічного потенціалу матиме вигляд:
ΔG = – RT lnK – RT ln aO2, (1.8)
Показуючи значення енергії Гіббса через величини рівноважного  парціального РО2 тиску кисню, отримаємо:
парціального РО2 тиску кисню, отримаємо:
ΔG = – RT ln  – RT lnPO2 = – RT ln
– RT lnPO2 = – RT ln  . (1.9)
. (1.9)
Рівняння дозволяє оцінити можливість перебігу процесу окислення. Якщо РО2 >  , то процес окислення можливий, так як в цих умовах ΔG < 0. Якщо РО2 <
, то процес окислення можливий, так як в цих умовах ΔG < 0. Якщо РО2 <  , то окислення неможливе, бо при цьому ΔG > 0. Цей принцип використовують для запобігання газової корозії в ряді технологічних операцій, наприклад, в металургії. Знижуючи парціальний тиск РО2 в газовому середовищі, оберігають метал від окислення при високих температурах.
, то окислення неможливе, бо при цьому ΔG > 0. Цей принцип використовують для запобігання газової корозії в ряді технологічних операцій, наприклад, в металургії. Знижуючи парціальний тиск РО2 в газовому середовищі, оберігають метал від окислення при високих температурах.
1.4. Корозія металів в неелектролітах
Корозія в неелектролітах - це корозія в рідинах, що не проводять електричний струм. До неелектролітів належать, наприклад, бром, розплавлена сірка, багато органічних речовин (бензол, хлороформ, фенол тощо), рідке паливо (нафта, гас, бензин), мастила. Корозія металів і сплавів в безводних розчинах неелектролітів протікає з меншою швидкістю, ніж у розчинах електролітів, і переважно за хімічним механізмом. Проте все ж таки призводить до значних руйнувань металевої апаратури. Розплавлена сірка хімічно активна і реагує майже з усіма металами. В її присутності сильно кородує мідь, олово, свинець, меншою мірою - вуглецева сталь і титан, і незначною мірою - алюміній. Вологий хлор викликає сильну корозію апаратури. У його середовищі стійким є тільки титан і неметалеві матеріали. При зниженні концентрації вологи до 0,04% можливе застосування сталевої апаратури. Для збільшення корозійної стійкості сталевих поверхонь за умови при можливого проскоку недостатньо осушеного хлору рекомендується покривати сталеві деталі захисним шаром нікелю. Так, при товщині шару нікелевого 30 мкм такі деталі зберігають корозійну стійкість при 20 °С в хлорі, вологість якого складає 0,3%. Рідкий бром взаємодіє при кімнатній температурі з багатьма металами. До них відносяться мідь, срібло, алюміній, олово, титан, хром, залізо, вуглецеві сталі і т.д. Для зберігання рідкого брому запропоновані сталеві ємності, гомогенно освинцьовані всередині. Застосовують також покриття з чистого нікелю. Більшість органічних рідин, що не містять води та інших домішок, інертні по відношенню до сталі. Але присутність вологи, навіть у незначних кількостях, створює агресивне середовище, хімічна корозія переходить в електрохімічну, і процес окислення металу прискорюється. Так, сталь в тетрахлориді вуглецю є корозійностійкою. При попаданні слідів вологи відбувається гідроліз ССL4 :
CCL4 + H2O = CCL3OH + HCL
Утворюється агресивне електропровідне середовище, яке викликає сильну корозію сталі. Корозійна активність нафти та продуктів її переробки визначається вмістом у ній сполук сірки - сірководню, і меркаптанів (тіоспиртів із загальною формулою (R-SН)). Ці сполуки викликають корозію кобальту, нікелю, свинцю, олова, міді та інших металів за рахунок утворення на поверхні сульфідів і меркаптидів металу типу RS-Ме-SR. Чим більше в рідких продуктах сірки, тим сильніше корозія. Так, в мазуті, що містить 3,7% сірки, швидкість корозії сталі (0,12% С) в 6 разів більше, ніж в мазуті, що містить 0,5% сірки. Сталь може кородувати при зіткненні з бензинами, так як вуглеводні бензинів окислюються під дією кисню повітря, утворюючи органічні кислоти. Металеві вироби, що працюють в розчинах неелектролітів, готують з матеріалів, стійких в даному середовищі. Високохромисті сталі використовують при виготовленні апаратури для переробки нафти. Широко застосовують нанесення на поверхню сталі захисних покриттів.
Питання для самоперевірки
1. Вкажіть умови, при яких протікає газова корозія.
2. Що називається жаростійкістю і жароміцністю металу?
3. Наведіть визначення хімічного механізму корозії. За яких умов він реалізується в газовій фазі?
4. Які типи кристалічних решіток вам відомі?
5. Які ви знаєте дефекти кристалічних решіток?
6. Які зміни структури металу відбуваються при його затвердінні?
7. Наведіть основне рівняння термодинаміки.
8. Проаналізуйте вплив парціального тиску кисню (Ро2) на можливість протікання реакції окислення металу.
1.5 Основні стадії газової корозії металів
Утворення продуктів корозії здійснюється в результаті протікання ряду послідовних і паралельних реакцій. На рис. 1.5 представлена схема утворення суцільної оксидної плівки при окислюванні металу киснем з газової фази. Процес окислення металу протікає в кілька стадій:
1. іонізація металу і перехід його у формі іонів і електронів в шар оксиду;
2. переміщення іонів металу Меn + і електронів в шарі оксиду;
3. перенос кисню з газового потоку до поверхні оксиду;
4. адсорбція кисню на поверхні;
5. перетворення адсорбованого кисню в іон О2-;
6. переміщення іонів кисню О2-в шарі оксиду;
7. реакція утворення оксиду.
У деяких випадках окремі стадії процесу можуть випадати або трансформуватися. Але загалом всі стадії процесу взаємопов'язані і протікають послідовно. Сумарна швидкість процесу визначається швидкістю найповільнішого реакції.
Наприклад, якщо повільно протікає стадія (3), то процес лімітується зовнішньою дифузією, якщо (1), (2) або (6) - має місце внутрішньодифузійний контроль процесу. Відмінною особливістю газової корозії металу є в окремих випадках затухання процесу в часі. Це відбувається тоді, коли на поверхні металу утворюється захисна плівка. Якщо ця плівка є суцільною і має хорошу адгезію з поверхні, то вона ізолює метал від контакту з агресивним середовищем і корозія припиняється. Першим етапом цього процесу має бути адсорбція окислювача на поверхні, закономірності якої будуть розібрані нижче.

Рисунок 1.5. Схема процесу утворення оксидної плівки на металі.
1.6. Адсорбція газів на поверхні металів
Адсорбцією називають зміну концентрації речовини на межі розділу фаз. Адсорбційна рівновага, тобто рівноважний розподіл речовини між прикордонним шаром і фазами, що межують між собою, є динамічною і швидко встановлюється. Частинки, які знаходяться на поверхні твердого тіла, володіють надлишковою енергією. За рахунок цього молекули навколишнього середовища притягуються до металу і концентруються на його поверхні. Цей процес протікає завжди мимоволі і з позитивним тепловим ефектом. Розрізняють два види адсорбції: фізичну і хімічну. Фізична адсорбція зумовлена вандерваальсовскими силами. Енергія зв'язку між молекулами адсорбату і поверхнею металу невелика (близько 40-50 кДж / моль). Рівновага встановлюється швидко. Адсорбовані речовини можуть бути легко видалені з поверхні. Фізична адсорбція найбільш чітко проявляється при низьких температурах, близьких до температури конденсації адсорбата. Хемосорбції називається процес адсорбції, що супроводжується хімічною реакцією між молекулами адсорбованої речовини і металом. Енергія зв'язку між атомами оцінюється величинами 150-160 кДж / моль. Зв'язок, що виникає між металом і окислювачем, має іонний характер. Метал віддає атому адсорбованого речовини електрони. Процес хемосорбції протікає дуже швидко (частки секунди). Зовнішня поверхня адсорбованої плівки при цьому заряджається негативно, а внутрішня - позитивно. Кількість адсорбованого речовини, віднесене до одиниці поверхні, залежить від температури середовища і концентрації адсорбату в газовій або рідкій фазі. Функціональна залежність між рівноважною кількістю адсорбата на поверхні твердого тіла і концентрацією або тиском Р (якщо адсорбат є газом) при Т = соnst; називається ізотермою адсорбції. Вперше теоретичне обгрунтування ізотерми адсорбції було дано Ленгмюром. Їм було зроблено декілька припущень, що спрощують модель процесу. Передбачалося, що:
- поверхню адсорбенту енергетично однорідна;
- частинки адсорбату на поверхні ніяк не взаємодіють один з одним;