Гемоглобинні синтезі
Ф КГМУ 4/3-04/03
ИП №6 от 14 июня 2007 г.
Араанды мемлекеттік медицина университеті
Биологиялы химия кафедрасы
ДРІС 12(Кредит 3 –жалпы шолу)
Таырыбы: «Хромопротеидтер алмасуы»
Пн Биологиялы химия
Мамандыы – 051301 – Жалпы медицина
Курс II
Уаыты (затыы) 50 минут
Араанды 2015 ж.
Кафедра отырысында талыланып жне бекітілді
Хаттама №_____ "____"__________2015 ж.
Кафедра мегерушісі, профессор ______________ Л.Е. Муравлева
Таырыбы: Хромопротеидтер алмасуы
Масаты: Темір алмасуымен таныстыру
Дрісті жоспары:
- Темір тасымалдануы.
- Гем синтезі.
Темір алмасуы
Теміррамды протеиндерді биосинтезі шін ажетті темірді шыу кзі таам німдері болып табылады. Біра, таам теміріні 10%-а жуыы ана сііріледі. Бауыр мен ккбауыр жасушаларында эритроциттерді траты ыдырауын кезінде босатылатын темір, айтадан, теміррамды протеиндерді синтезі шін пайдаланылады. Асазандаы ышылды орта жне таам рамындаы аскорбин ышылы темірді таамды органикалы заттармен тздарынан кп млшерде босатылуын амтамассыз етеді жне сіірілуін жасартады.
Темірді энтероциттерден ана тсуі олардаы синтезделетін апоферритин протеиніні синтезделу жылдамдыына туелді болады. Апоферритин ішекті шырышты жасушаларында темірді зіне байланыстырады да ферритинге айналады. Ол энтероциттерде алады. Бл жадай темірді ішек жасушаларынан ан капиллярларына тсуін тмендетеді. Азада темір ажеттілігі аз боланда апоферритин синтезіні жылдамдыы жоарлайды. Ішекті шырышты жасушаларыны солуы (слущивание) кезінде аза арты темірден босатылады. Азада темірді жетіспеушілігі кезінде апоферритин энтероциттерде млдеге жуы синтезделмейді.
ан ферменті ферроксидаза (церулоплазмин) темірді тотытырады, ол андаы гликопроетин трансферринмен байланысады жне ан рамында тасымалданады.
Трансферрин арнайы рецепторлармен байланысып аннан жасушаа тседі. Трансферрин рецепторларыны млшері жасушадаы темір млшеріне туелді жне протеин-рецепторды геніні транскрипциясы дегейінде реттеледі. Жасушадаы темір млшеріні азаюы кезінде рецепторларды синтезделу жылдамдыы жоарлайды жне керісінше.
Ферритин протеині бауырда, ккбауырда, жілік майында темір депосы ролін атарады.
Темірді арты млшері бауыр жне баса да лпаларда гемосидерин грануласы рамында аккумуляциаланады. Гемосидерин – бл протеиннен, полисахаридтен жне е2+ -ден тратын комплекс, суда нашар ериді жне рамында 3%-а дейін темір болады.
Бауыр мен ккбауырды ретикуло-эндотелиоциттеріндегі гемосидерин гранулаларыны жинаталуы бл мшелерді ызметі бзылуына (гемохроматоз) келуі ммкін.
Темірді жеткіліксіз тсуі немесе жмсалуыны бзылысы кезінде теміржетіспеушілік анемия дамиды.
Медициналы маызы
Гемоглобинніалыпты млшеріні мндері: - ерлерде 130 - 160 г/л; - йелдерде 120 – 140 г/л.
Гемоглобинні концентрациясыны жоарлауы: полицитемия, дегитратация кезіндегі гемоконцентрация, кюде, ішек аталауында, атты суда; те биікте боланда, шамадан тыс физикалы жктемеде немесе оздырыланда; жрек-антамырлары патологиясында, негізінен туабіткен; кейбір кпе ауруларында, мет- жне сульфогемоглобин тзілуін дамытатын нитрит, сульфониламидтерді созылмалы химиялы серінде болады. Гемоглобин концентрациясыны жоары болуы да - анемия.
Гемоглобинні синтезі
Гемоглобин биосинтезіні 85%-а жуыы жілік майында теді жне тек аздаан блігі ана – бауырда теді. Гем синтезіне митохондрия да, цитоплазма да атысады.гем жне глобин жеке синтезделеді.тек сонан кейін ана олар зара байланысып гемоглобинні шінші жне тртінші реттік рылымдары тзіледі.
Бастапыда, митохондрияда пирролды саиналарды синтезі басталады. Сукцинил-СоА глицинмен конденсацияланып жне ары арай ол декарбоксилденіп -аминолевулинат (-аминолевулин ышылы) (ALA) тзіледі. Бл стадияа атысатын фермент -аминолевулинатсинтаза барлы синтез жолыны негізгі ферменті болып табылады жне оны жылдамдыы барлы синтезді негізгі айындаушысы.

-Аминолевулинатсинтазаны коферменті пиридоксальфосфат (В6 –витамині туындысы) болып табылады. Фермент гемні арты млшері арылы кері теріс байланыс принципі бойынша ингибирленеді.
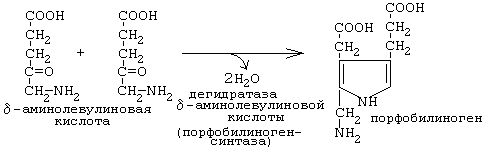
-Аминолевулинат синтезделген со митохондриядан цитоплазмаа шыарылады жне екі молекуласы конденсацияланып порфобилиногенге (рамында пирролды саинасы бар болады) айналады. Порфобилиногенсинтаза орасын ионы арылы ингибирленеді. Сондытан, орасынмен жедел уланан кезде анда жне несепте -аминолевулинатты жоары концентрациясы аныталады. Порфобилиногенсинтаза да гемні арты млшерінен ингибирленеді.
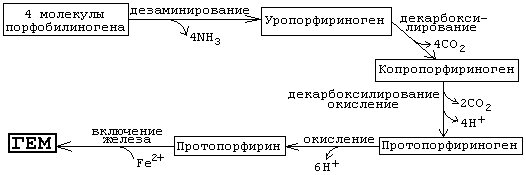
Ары арайы стадияларда порфиринге тн тетрапирролды рылым алыптасады. Порфобилиногенні 4 молекуласы байланысуы NН2 –топты блінуі жне уропорфириноген ІІІ тзілуіне келеді. Бл реакция гидроксиметилбилансинтаза ферментімен катализденеді. Бл аралы нім тзілуі шін екінші фермент уропорфириноген ІІІ-синтаза ажет. Бл ферментті болмауы «брыс» изомер – уропорфириноген І тзілуіне келеді.
Уропорфириноген ІІІ-ті тетрапирролды рылымы гемдегі рылысынан айырмашылыта болады. Мысалы, орталыында темір ионы жо жне саинада 11 осбайланысорнына 8 осбайланыс ана болады. Саинада тек бйірлік зарядталан тізбектер R ана (4 ацетатты жне 4 пропионатты алдытар) болады. Протеинні рамындаы гем тобы полярсыз оршауда ызмет атарады. Алашыда 4 ацетатты алды (R1) метилдік топ тзіп декарбоксилденеді. Нтижесінде тзілген копропорфириноген ІІІ айтадан митохондрияа тседі. Ары арайы реакциялар митохондрияда шоырланан ферменттер арылы катализденеді. Фермент оксидазаларды серінен екі пропионатты топтар (R2) винилдік алдытара айналады. Бйір тізбектеріні трленуі протопорфириноген ІХтзілуімен аяталады.
Ары арай молекула тотыу нтижесінде -электронды осарланан алыпа ауысады. Сондытан, гем зіне тн ызыл тсте болады. бл жадайда 6 тотысыздандырыш эквиваленттер жмсалады. Соында арнайы фермент феррохелатаза арылы молекулаа темірді екі валентті ионы осылады. Осындай жолмен тзілген гем немесе е-протопорфирин ІХ протеин рамына осылып гемопротеин (гемоглобин, миоглобин) тзіледі. Олардаы гем саинасы ковалентсіз байланысан, ал цитохром С –да ковалентті байланысан болады.
Гем синтезіне ажетті темірді шыу кзі – ферритин протеині. Азада ферритин комплексі трінде темірді резерві (деполануы) саталады.
Баылау сратары:
1. Темір алмасуыны маызы неде.
2. Гемні гемоглобин синтезі шін маызы.
Крнектілік рал:
Анимациялар
дебиет:
Е. С. Северин баспасы, Биохимия: оулы; аза тіл. аударан жне жауапты ред. А. Ж. Сейтембетова, 2014, ГЭОТАР-Медиа. - 752 б.
бдіраов Б.. Биохимия: оу ралы, 2014, Эверо. - 98 б
Сеитов З.С. ,Биохимия : Оулы / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б