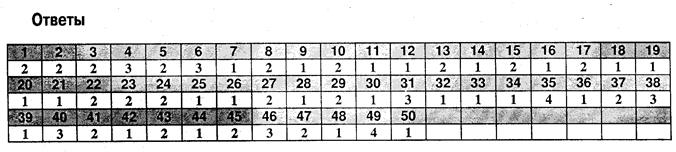
Буферные растворы, буферные системы организма
1. Значения рН буферных растворов при добавлении небольших количеств кислот и оснований:
1) сохраняются постоянными, т. к. добавляемые катионы водорода и анионы гидроксила связываются соответственно акцепторами и донорами протонов буферной системы;
2) сохраняются примерно постоянными до тех пор, пока концентрации компонентов буферных систем будут превышать концентрации добавляемых ионов;
3) изменяются, т. к. изменяются концентрации кислот и оснований в системе.
2.Значения рН буферных растворов при разбавлении:
1) сохраняются постоянными, т. к. соотношение концентраций компонентов буферных систем не изменяется;
2) сохраняются примерно постоянными до определённых значений концентраций;
3) изменяются, т. к. концентрация компонентов системы уменьшается.
3. Какие из перечисленных сопряженных кислотно-основных пар обладают буферными свойствами? а) НСОО-/НСООН;
б) CH3СОО-/СН3СООН; в) Cl-/НС1; г) НСО3-/СО2, д) HPO42-/H2PO4-.
1) все;
2) а, б, г, д;
3) б, г, д;
4) б, г.
4. Из перечисленных сопряженных кислотно-основных пар выберите системы, обладающие буферными свойствами: a) H3PO4/H2PO4-
б) H2PO4-/HPO42-; в) HPO42-/PO43- г) HNO3/NO3-; д) НСООН/НСОО-.
1) все;
2) б, д;
3) а, б, в, д;
4) б, в, д.
5. Какие из кислотно-основных пар обладают буферными свойствами? а) Hb-/ННb; б) НbО2-/ННbО2; в) НСО3-/СО2; г) NH4+/NH4OH;
д) NO3-/HNO3?
1) все;
2) а, б, в, г;
3) а, б, в;
4) д.
6. Какие из кислотно-основных пар обладают буферными свойствами? а) С1-/НС1; б) NO3-/HNO3; в) HSO4-/H2SO4; г) СН3СОО-/СН3СООН;
д) NH4+/NH4OH?
1) все;
2) а, б, в;
3) г, д;
4) в, г, д.
7.Какие из сопряженных кислотно-основных пар обладают буферными свойствами?
а) НСОО-/НСООН; б) НРО42-/Н2РО4-; в) Н2РО4-/Н3РО4; г) НСО3-/СО2?
1) все;
2) а, б;
3) б, в, г;
4) а, г.
8. Какие из буферных систем содержат в своем составе только соли: а) СО32-/НСО3-;
б) НСО3-/СО2; в) HPO42-/ Н2РО4-; г) Н2РО4-/Н3РО4; д) НСОО-/НСООН; е) РО43-/НРО42-.
1) а, в, г;
2) а, в, е;
3) а, б, в, г, е;
4) а, б, в, г.
9. К буферным растворам относятся смеси; a) NaH2PO4 + Na2HPO4; б) Н3РО4 + NaH2PO4;
в) Na2CO3 + NaHCO3; г) Na2HPO4 + Na3PO4.
1) все;
2) а, б;
3) в, г;
4) а, б, в.
10. При добавлении НСl к буферной системе НРО42-/Н2РО4-:
1) активная концентрация (НРО42-)увеличивается, (Н2РО4-) - уменьшается;
2) активная концентрация (НРО42-) уменьшается, (Н2РО4-) - увеличивается;
3) активности компонентов не изменяются.
11.При добавлении NaOH к буферной системе НРО42-/Н2РО4-:
1) активная концентрация (НРО42-) увеличивается, (Н2РО4-) - уменьшается;
2) активная концентрация (Н2РО4-) увеличивается, (НРО42-) - уменьшается;
3) активные концентрации (НРО4-) и (Н2РО4-) не изменяются.
12. При добавлении NaOH к буферной системе NH4+/ NH3·H2O:
1) активная концентрация (NH4+) уменьшается, (NH3·H2O) увеличивается;
2) активная концентрация (NH4+) увеличивается, (NH3·H2O) уменьшается;
3) активные концентрации (NH4+) и (NH3·H2O) не изменяются.
13. При добавлении НСl к буферной системе NH4+/ NH3·H2O:
1) активная концентрация (NH4+) уменьшается, (NH3·H2O) - увеличивается;
2) активная концентрация (NH4+) увеличивается, (NH3·H2O) - уменьшается;
3) активные концентрации (NH4+) и (NH3·H2O) не изменяются.
14.При добавлении NaOH к буферной системе СН3СОО-/СН3СООН:
1) активная концентрация (СН3СООН) уменьшается, (СН3СОО-) - увеличивается;
2) активная концентрация (СН3СООН) увеличивается, (СН3СОО-) - уменьшается;
3) активные концентрации (СН3СООН) и (СН3СОО-) не изменяются.
15. При добавлении НСl к буферной системе СН3СОО-/СН3СООН:
1) активная концентрация (СН3СООН) уменьшается, (СН3СОО-) увеличивается;
2) активная концентрация (СН3СООН) увеличивается, (СН3СОО-) уменьшается;
3) активные концентрации (СН3СООН) и (СН3СОО-) не изменяются.
16. Максимальную буферную ёмкость системы имеют при:
1) рН = pKa;
2) рН > рKa;
3) pH< pKa;
4) эти параметры не взаимосвязаны друг с другом.
17. Максимальной буферной ёмкостью при физиологическом значении рН обладает кислотно-основная сопряженная пара:
1) Н3РО4/Н2РО4- (рКа (Н3РО4) = 2,1;
2) Н2РО4-/НРО42- (рКа (Н2РО4-) = 6,8;
3) НРО42-/РО43-(рКа (НРО42-) = 12,3.
18. При одинаковых концентрациях компонентов буферная ёмкость:
1) максимальна, т. к. рН = pKa;
2) максимальна, т. к. рН > pKa;
3) минимальна, т. к. рН = pKa;
4) буферная ёмкость не зависит от соотношения концентраций компонентов.
19. Буферная ёмкость при разбавлении растворов:
1) уменьшается, вследствие уменьшения концентрации всех компонентов системы;
2) увеличивается, т. к. возрастает степень диссоциации электролитов;
3) не изменяется, т. к. соотношение концентраций компонентов остается постоянным;
4) практически не изменяется, т. к. количество компонентов системы остается неизменным.
20. Буферные системы поддерживают в организме равновесия:
1) кислотно-основные;
2) окислительно-восстановительные;
3) гетерогенные;
4) лигандообменные.
21. Ацидоз - это:
1) уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2) увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3) увеличение основной буферной ёмкости физиологи ческой системы по сравнению с нормой.
22. Алкалоз - это:
1) уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2) увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3) уменьшение основной буферной ёмкости физиологической системы по сравнению с нормой.
23. Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары:
1) Н3РО4 - кислота, Н2РО4- - сопряженное основание;
2) Н2РО4- - кислота, НРО42- - сопряженное основание;
3) НРО42- - кислота, РО43- - сопряженное основание;
4) Н3РО4 - кислота, РО43-- сопряженное основание.
24.При рН > рI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1) биполярной молекулы белка (NH3+—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
2) биполярной молекулы белка (NH3+—Prot—COO-) и аниона белка (NH2—Prot—COO-);
3) аниона белка (NH2—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
4) белка (NH2- Prot - СООН) и аниона белка (NH2—Prot—COO-).
25. При рН < pI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1) биполярной молекулы белка (NH3+—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
2) биполярной молекулы белка (NH3+—Prot—COO-) и аниона белка (NH2—Prot—COO-);
3) аниона белка (NH2—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
4) белка (NH2—Prot—СООН) и катиона белка (NH3+—Prot—COOH).
26. При рН > рI глицин образует сопряженную кислотно-основную пару:
1) NH3+–СН2 – COO- / NH2–СН2–СОО-;
2) NH3+–СН2 –COO- / NH3+–СН2–СООН;
3) NH2–СН2–СООН / NH2–CH2–COO-;
4) NH2–CH2–COO- / NH3+–СН2– СООН.
27. При рН < рI глицин образует сопряженную кислотно-основную пару:
1) NH3+–СН2–COO- / NH2–СН2–СОО-;
2) NH3+–СН2–COO- / NH3+–СН2–СООН;
3) NH2–СН2–СООН / NH2–CH2–COO-;
4) NH2–CH2–COO- / NH3+–СН2– СООН.
28. Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде,
(рI = 4,9-6,3), поэтому в крови в основном работает:
1) анионный белковый буфер;
2) катионный белковый буфер;
3) форма компонентов буфера не зависит от значения рН.
29. Буферная ёмкость свободных аминокислот плазмы крови максимальна при:
1) рI = рН;
2) рI < рН;
3) рI > рН;
4) буферная ёмкость не зависит от значения рН.
30.Буферная ёмкость белковой буферной системы крови больше:
1) по кислоте, т. к. в крови работает анионный белковый буфер;
2) по основанию, т. к. в крови работает катионный белковый буфер;
3) по кислоте, т. к. в крови работает катионный белковый буфер;
4) по основанию, т. к. в крови работает анионный белковый буфер.
31. Физиологическое значение рН поддерживается при соотношении компонентов бикарбонатной буферной системы, равном:
1) НСО3-/СО2 = 1:18;
2) НСО3-/СО2 = 4:1;
3) НСО3-/СО2 = 18:1;
4) НСО3-/СО2 = 1:4.
32. Физиологическое значение рН поддерживается при соотношении компонентов фосфатной буферной системы, равном:
1) НРО42-/Н2РО4- = 4:1;
2) НРО42-/Н2РО4- = 18:1;
3) Н2РО4-/НРО42- = 4:1;
4) НРО42-/Н2РО4- = 1:18.
33. При физиологическом значении рН соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [НСО]/[СО2]. = 18:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1) больше;
2) меньше;
3) их значения равны.
34. При физиологическом значении рН соотношение концентраций компонентов в фосфатной буферной системе крови [НРО]/[Н2РО] = 4:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1) больше;
2) меньше;
3) их значения равны.
35. В организме имеет место следующее равновесие:
Н+ + НСО3-  H2CO3
H2CO3  H2O + CO2 (плазма)
H2O + CO2 (плазма)  CO2 (лёгкие).
CO2 (лёгкие).
При гиповентиляции легких:
1) щелочной резерв крови уменьшается, рН мочи увеличивается;
2) щелочной резерв крови уменьшается, рН мочи уменьшается;
3) щелочной резерв крови увеличивается, рН мочи увеличивается;
4) щелочной резерв крови увеличивается, рН мочи уменьшается.
36. В организме имеет место следующее равновесие:
Н+ + НСО3-  H2CO3
H2CO3  H2O + CO2 (плазма)
H2O + CO2 (плазма)  CO2 (лёгкие).
CO2 (лёгкие).
При гипервентиляции легких:
1) щелочной резерв крови уменьшается, рН мочи увеличивается;
2) щелочной резерв крови уменьшается, рН мочи уменьшается;
3) щелочной резерв крови увеличивается, рН мочи увеличивается;
4) щелочной резерв крови увеличивается, рН мочи уменьшается.
37. При гипотермии температуру в организме понижают до 24 °С. В этом режиме проводятся операции при патологии кровообращения. Значение рН = 7,36 будет в этом случае:
1) нормой;
2) ацидозом;
3) алкалозом.
38. При интенсивной физической нагрузке развивается метаболический ацидоз. Какой режим дыхания можно рекомендовать спринтеру перед началом бега для предварительной компенсации метаболического ацидоза?
1) гиповентиляцию лёгких;
2) режим дыхания не имеет значения;
3) гипервентиляцию легких.
39. Метод волевой ликвидации глубокого дыхания (МВЛГД), рекомендованный Бутейко, приводит к увеличению содержания СО2 в лёгких. При этом развивается:
1) респираторный ацидоз;
2) рН не изменяется;
3) респираторный алкалоз;
4) метаболический алкалоз.
40. У больных сахарным диабетом за счёт накопления в организме -гидроксимасляной кислоты развивается:
1) метаболический алкалоз;
2) респираторный алкалоз;
3) метаболический ацидоз;
4) респираторный ацидоз.
41. При вдыхании чистого кислорода за счёт уменьшения парциального давления СО2 в лёгких развивается:
1) респираторный ацидоз;
2) респираторный алкалоз;
3) рН не изменяется;
4) метаболический ацидоз.
42. При заболеваниях, связанных с нарушением дыхательной функции лёгких (бронхите, воспалении легких и т. п.), приводящим к увеличению содержания СО2 в лёгких, наблюдается:
1) дыхательный ацидоз;
2) рН не изменяется;
3) дыхательный алкалоз;
4) метаболический алкалоз.
43. Увеличение щелочных продуктов метаболизма концентрацию СО2 в плазме крови:
1) увеличивает
2) уменьшает;
3) не изменяет.
44. Увеличение кислотных продуктов метаболизма концентрацию СО2 в плазме крови:
1) увеличивает;
2) уменьшает;
3) не изменяет.
45. Фосфатная буферная система действует:
1) в плазме крови;
2) в плазме крови и во внутренней среде эритроцитов;
3) во внутренней среде эритроцитов.
46. Гемоглобиновая буферная система действует:
1) в плазме крови;
2) в плазме крови и во внутренней среде эритроцитов;
3) во внутренней среде эритроцитов.
47. Наиболее быстродействующей в организме является буферная система:
1) фосфатная;
2) гидрокарбонатная;
3) белковая;
4) гемоглобиновая.
48. Максимальный относительный вклад в поддержание протолитического гомеостаза в плазме крови вносит буферная система:
1) гидрокарбонатная;
2) белковая;
3) гидрофосфатная;
4) гемоглобиновая.
49.Максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов вносит буферная система:
1) гидрокарбонатная;
2) белковая;
3) гидрофосфатная;
4) гемоглобиновая.
50. При увеличении концентрации протонов во внутриклеточной жидкости происходит их нейтрализация гидрофосфат-ионами согласно уравнению реакции:
Н+ + HPO42-  Н2РО4-.
Н2РО4-.
При этом рН мочи:
1) уменьшается;
2) увеличивается;
3) не изменяется.