Определение электропроводности слабых электролитов
Лабораторная работа № 16
Проводники электрического тока делятся на проводники первого и второго рода. К проводникам первого рода относятся металлы и их сплавы, графит и другие материалы. Проводниками второго рода называют растворы кислот, щелочей и солей, расплавленные соли и кристаллы некоторых твердых солей.
Перенос электричества в проводниках первого рода осуществляется движением электронов по проводнику, в проводниках второго рода перенос электричества осуществляется движением ионов, и сила тока представляет собой суммарный результат движения катионов и анионов. Сопротивление, а, следовательно, и электропроводность зависит от длины и поперечного сечения проводника, а именно: 
 , где /1/
, где /1/
 - сопротивление проводника (Ом);
- сопротивление проводника (Ом);
 - длина проводника (см);
- длина проводника (см);
 - площадь поперечного сечения (см2);
- площадь поперечного сечения (см2);
 - удельное сопротивление (Ом . см).
- удельное сопротивление (Ом . см).
Электропроводность – величина, обратная сопротивлению электрического тока, т.е.
 = æ
= æ  , /2/
, /2/
где æ – удельная электропроводность, æ =  (Ом-1 .см-1);
(Ом-1 .см-1);
 - длина проводника (см);
- длина проводника (см);
S – поперечное сечение проводника (см2).
Удельной электропроводностью называют электропроводность одного мл раствора, помещенного между электродами с поверхностью 1 см2, находящимися на расстоянии 1 см друг от друга.
Удельная электропроводность различных электролитов, сравниваемая при одинаковых условиях, температуре и концентрации, различна. Удельная электропроводность слабых электролитов с повышением концентрации растет незначительно. Уменьшение ее вызвано падением степени диссоциации. Удельная электропроводность с уменьшением концентрации падает, но не пропорционально, она убывает медленнее, чем разведение раствора. Только в очень разбавленных растворах солей, сильных кислот и оснований обе величины становятся пропорциональными.
Более наглядно выглядят эти закономерности, если пользоваться не удельной, а эквивалентной электропроводностью. Она зависит от свойств растворенного вещества, выражающихся в способности переносить в единицу времени большего или меньшего количества электричества. Способность различных электролитов проводить электрический ток удобно сравнивать в таких условиях, когда в слое жидкости, заключенном между электродами, находятся химически сравнимые количества различных веществ. Такими химически сравнимыми количествами являются грамм-эквивалент или грамм-моль вещества.
Эквивалентной электропроводностью называют электропроводность столба жидкости, заключенного между электродами, находящимися друг от друга на расстоянии 1 см при такой площади поверхности электродов, что между ними находится объем жидкости, содержащий 1 грамм-эквивалент вещества.
 æ = 1000 . V . æ, [Ом-1 . см-1 . м-1], где /3/
æ = 1000 . V . æ, [Ом-1 . см-1 . м-1], где /3/
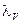 - эквивалентная электропроводность при данном разведении;
- эквивалентная электропроводность при данном разведении;
С – концентрация раствора;
 - разбавление раствора, т.е. величина, обратная концентрации (
- разбавление раствора, т.е. величина, обратная концентрации (  = 1 / С).
= 1 / С).
Эквивалентная электропроводность раствора повышается при его разбавлении благодаря тому, что количество электролита между электродами остается постоянным (грамм-эквивалент), а число ионов, образующихся при разбавлении, увеличивается.
очень сложно выполнить все условия. Поэтому для каждого сосуда предварительно определяют его постоянную С0.
Если в формулу  вместо
вместо  поставить 1/ æ, а величину
поставить 1/ æ, а величину 
 заменить на С0, то
заменить на С0, то  С0/ æ.
С0/ æ.
Отсюда можно заключить, что С0 = æ .  х,
х,
где  х – сопротивление, определяемое по формуле Rх = Rм .
х – сопротивление, определяемое по формуле Rх = Rм .  .
.
Практически постоянную сосуда (С0) определяют следующим образом.
В сосуд для измерения электропроводности наливают 0,02 н раствор хлорида калия таким образом, чтобы в раствор были погружены только электроды. Из таблиц определяют удельную электропроводность хлорида калия (æ) при данной температуре. Далее, описанным выше способом, определяют сопротивление раствора хлористого калия и находят постоянную сосуда С0 =æ.  х .
х .
Данные измерений заносят в таблицы:
Таблица 1
Определение постоянной сосуда (С0)
| № | Rм | Плечи реохорда | Rх | С0 | |
 а а
| б | ||||
Рассчитать среднее значение С0.