Биологические свойства меди
Медь и её соединения.
Получение
Пирометаллургия:
CuO + C  Cu + CO
Cu + CO
CuO + CO  Cu + CO2
Cu + CO2
Гидрометаллургия:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
CuSO4 + Fe  FeSO4 + Cu
FeSO4 + Cu
Электролиз:
2CuSO4 + 2H2O  2Cu + O2
2Cu + O2 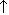 + 2H2SO4
+ 2H2SO4
(на катоде) (на аноде)
Химические свойства
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2  2CuO
2CuO
Cu + Cl2  CuCl2
CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.)  3Cu(NO3)2 + 2NO
3Cu(NO3)2 + 2NO 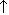 + 2H2O
+ 2H2O
Cu + 4HNO3(конц.)  Cu(NO3)2 + 2NO2
Cu(NO3)2 + 2NO2 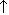 + 2H2O
+ 2H2O
Cu + 2H2SO4(конц.)  CuSO4 + SO2
CuSO4 + SO2 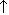 +2H2O
+2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3  [Cu(NH3)2]Cl
[Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH  Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
CuO + 2HNO3  Cu(NO3)2 + H2O
Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH  Cu(OH)2
Cu(OH)2 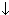 + Na2SO4
+ Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2  CuO + H2O
CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl  CuCl2 + 2H2O
CuCl2 + 2H2O
Cu(OH)2 + 2H+  Cu2+ + 2H2O
Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3  [Cu(NH3)4](OH)2
[Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O  Cu2(OH)2CO3
Cu2(OH)2CO3 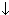 + 2Na2SO4 + CO2
+ 2Na2SO4 + CO2 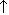
Разложение малахита:
Cu2(OH)2CO3  2CuO + CO2
2CuO + CO2 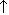 + H2O
+ H2O
Серебро и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S + O2  2Ag2S + 2H2O
2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(разб.)  3AgNO3 + NO
3AgNO3 + NO 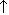 + 2H2O
+ 2H2O
Ag + 2HNO3(конц.)  AgNO3 + NO2
AgNO3 + NO2 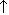 + H2O
+ H2O
2Ag + 2H2SO4(конц.)  Ag2SO4 + SO2
Ag2SO4 + SO2 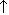 + 2H2O
+ 2H2O
В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl-  AgCl
AgCl 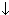 белый
белый
Ag+ + Br-  AgBr
AgBr 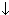 светло-жёлтый
светло-жёлтый
Ag+ + I-  AgI
AgI 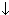 тёмно-жёлтый
тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH  Ag2O + 2NaNO3 + H2O
Ag2O + 2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3  [Ag(NH3)2]Cl
[Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O  2[Ag(NH3)2]OH
2[Ag(NH3)2]OH
Золото и его соединения
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот ("царской водке"):
Au + HNO3 + 4HCl  H[AuCl4] + NO
H[AuCl4] + NO 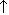 + 2H2O
+ 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2  2AuCl3
2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Биологические свойства меди
В 1893 году швейцарский ботаник Карл Негель доложил научному миру о своем открытии - антимикробном действии меди и серебра. Негели наблюдал гибель микроорганизмов в воде при концентрациях в ней металлов, составляющих миллионные доли от количества раствора, т.е. следовые. Эти свойства меди и серебра были названы олигодинамическими, от греческих слов «олигос» и «динамис». В буквальном переводе: «действие следа». Дальнейшими исследованиями было установлено, что наибольшим олигодинамическим действием обладает серебро. Действие меди в 4-5 раз слабее. Но взятые вместе, эти металлы многократно усиливают свойства друг друга. И свойства не только антимикробные. Медь играет ключевую метаболическую роль в обмене веществ всех живых организмов, начиная от простейшей клетки. Она входит в состав биологических катализаторов - ферментов. Без них невозможна жизнь. Именно поэтому биологи назвали медь «металлом жизни». Прямо или косвенно медь участвует в большинстве обменных процессов и является их главным регулятором.
Основная биохимическая функция меди в организме - это участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество меди в растениях колеблется от 0,0001 до 0,05% (на сухое вещество) и зависит от вида растения и содержания меди в почве. В растениях медь входит в состав ферментов-оксидаз и белка пластоцианина. В оптимальных концентрациях медь повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты медью некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианине содержится 0,15-0,26% меди). Поступая с пищей, медь всасывается в кишечнике, связывается с белком сыворотки крови - альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям.
Медь - очень важный для жизни металл. Содержание меди в организме человека колеблется (на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела - от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости. А всего меди в организме взрослого человека около 100 мг. Медь входит в состав ряда ферментов - тирозиназы, цитохромоксидазы, стимулирует кроветворную функцию костного мозга.
Ежедневный прием меди с пищей составляет 0,50-6 мг, из которых усваивается только 30%. Токсическая доза меди больше 250 мг. Попав в организм, соединение меди поступает в печень, которая является главным складом этого микроэлемента. Медь концентрируется также в мозге, сердце и почках, мышечной и костной тканях. Многие растения и животные концентрируют медь, и лечебное действие при их использовании связано в большей мере с этим элементом. Наиболее богаты медью шампиньоны, картофель, печень (особенно палтуса и трески), почки, яичный желток, цельное зерно, а также устрицы и каракатицы. В молоке и молочных продуктах ее очень мало, поэтому длительный молочный рацион может привести к недостаточности меди в организме.
Малые дозы меди влияют на обмен углеводов в организме (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и других. Увеличение содержания меди в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина. Однако избыток соединений меди также вреден, он может привести к тяжелым отравлениям. Вот почему не рекомендуется пользоваться при приготовлении пищи медной посудой: при кипячении в раствор может перейти избыточное количество меди. Можно лишь использовать медную посуду, хорошо облуженную изнутри, т.е. покрытую слоем олова.