Реагент №2. Гидроокись натрий
Кредит
Тақырыбы: Зертханалық практикум: ««Протеиндер. Ферменттер»»
Тақырыбы: Зертханалық практикум: «Витаминдер»
Кредит
Тақырыбы: Зертханалық практикум: «Көмірсулар алмасуы»
Тақырыбы: Зертханалық практикум: «Липидтер алмасуы»
Тақырыбы: Зертханалық практикум: «Протеин және аминоқышқылдар алмасуы»
Кредит
Тақырыбы: Зертханалық практикум: «Су-тұз алмасуының көрсеткіштері»
Тақырыбы: Зертханалық практикум: «Темір алмасуының көрсеткіштері»
Тақырыбы: Зертханалық практикум: «Қанның биохимиялық көрсеткіштері»
Кредит
Тақырыбы: Зертханалық практикум: «Коагуляциалық гемостаздың көрсеткіштері»
Пән: Bioh 2202 биологиялық химия
Мамандығы051301 - Жалпы медицина
Курс: 2
Құрастырғандар: каф. меңгерушісі, проф. Л.Е. Муравлева, доцент, б.ғ.к. Омарова Г.А., доцент, м.ғ.к. Д.А. Клюев, б.ғ.к. Позднякова Е.В, м.ғ.к. Х. Р.Абдикадирова.
Қарағанды 2014
Кафедра отырысында талқыланды және бекітілді
Хаттама№ _____ _______________2014 ж.
Кафедра меңгерушісі, проф. __________________Муравлева Л.Е.
Биохимиялық лабороториядағы жұмыстардың негізгі ережелері.
Лабороториялық жаттығуды ойдағыдай орындау үшін биохимия лабороториясының негізгі ережелерін білу қажет.
1. ЖАЛПЫ ТӘРТІП.
1.1.Кафедраға кіру үшін студенттердің ақ халаты мен басына киетін қалпағы болуы керек.
1.2. Оқу сабағы белгілі бір арнайы бөлмеде өткізіледі.
1.3. Әрбір студенттің лабороторияда өзіне бекітілген орны болады.
1.4. Жұмыс істеу орны әр уақытта таза болуы қажет.
1.5. Химиялық реактивтердің дәмін татуға рұқсат етілмейді. Жұмыс істеу үшін ең алдымен лабороториялық жұмысты орындаудың методикасын түсініп алу қажет, керекті химиялық реактивтерді алдын – ала дайындау қажет.
1.6. Егер лабороторияда оқытушы мен лаборант болмаса, студент жұмыс істеуге тиісті емес.
1.7. Лабороториялық жұмыс істеген кезде, студенттер шуламай тыныштық сақтаулары қажет, жқмысты асыөпай тыңғылықты жасау қажет. Жұмыс уақытында басқа істермен немесе әңгімемен лабороторияда айналысуға болмайды.
1.8. Лабороториялық жұмысты бітіргеннен кейін суды, электр энегиясын өщіру қажет. Ыдысты жуу, химиялық реактивтерді белгілі орнына қою керек.
Лабороториялық ыдыстармен жұмыс істеу
1.9. Лаборотоияда қолданылатын хитмиялық ыдыстарды жалпы арнайы және өлшуіш деп бөлуге болады.
2.0. Пробирка ұзынша келген цилиндр формалы ыдыс. Пробиркаларды белгілі бір пластмасса немесе темірден жасалған штативтер сақтайды.
Спиртовкамен жұмыс істеу.
2.1.Спиртовканың сырты құрғақ жіне білтесі белгілі биіктікте болуы керек.
2.2. Жанып тұрған спиртовканы тасымалдауға болмайды. Бір спиртовкадан екінші спиртовканы тұтандыруға болмайды. Қалпақпен сөндіру қажет.
Зақымданған адамға бірінші дәргерлік көмек көрсету.
2.3. Термиялық күйген кезде.
Бірінші көмек ретінде жанып кеткен киімді шешіп тпстау, күйген жерді спиртпен өңдеу, тазарту, егер күйікке арналған май болса, күйген жерді маймен бинтпен байлау.
2.4. Химиялық күйген кезде:
А) егер химиялық реактив адамның терісіне тисе, онда ол жерді судың өте көп мөлшерімен жуып тастау өажет;
Б) егер адамны ң аузына тисе, онда да сумен шаяды;
В) егер химиялық реактив адамның асқазанына тисе, она оны да судың көп мөлшерімен шаю қажет, сонан кейін арнайы дәрігерлік көмек көрсеті керек.
Г) егер химиялық реактив адамның көзіне тисе, онда оны да судың көп мөлшерімен шаю қажет, содан кейін арнайы дәргерлік көмек көрсету керек.
2.5. Электр тоғымен зақымданса – онда адам есін сақтау үшін таза ауа мен тыныштық тудыру қажет. Егер тынысы нашарласа немесе тынысы тоқтап қалса, дәргерлік көмек келгенше, қолдан демалдыру қажет.
1 КРЕДИТ
1-ші сабақ
Тақырыбы: Зертханалық практикум «Белоктар. Ферменттер»
Мақсаты:Биологиялық сұйықтықтардағы ферменттер белсенділігін және белоктардың сандық мөлшерін анықтаудың клиникалық диагностикалық маңыздылығын көрсету.
Сабақтың міндеттері:
· биологиялық сұйықтықтарда белоктар мөлшерін анықтау әдістерін үйрету
· ферменттер белсенділігін бақылау әдістерін үйрету
Тақырыптың негізгі сұрақтары:
1. Биологиялық сұйықтықтарда қалыпты және патологиялық жағдайлардағы белоктардың сандық мөлшерін анықтау. Биурет реакциясы.
2. Биологиялық сұйықтықтарда қалыпты және патологиялық жағдайлардағы ферменттер белсенділігін анықтау (сілекейден және несептен амилазаны)
3. Зерттеу нәтижелерін тіркеп жазу
4. Алынған нәтижелерді талдау
Оқыту және үйрету әдістері: биохимиялық әдістерді өткізу, хаттаманы құрастыру, алынған нәтижелерді талдау (TBL)
Әдебиет:
1. Биохимия: Оқулық (5 шығарылым) Северин Е.С. редакциясы, аударма Сейтембетова А.Ж. . – М.: ГЕОТАР-МЕД., 2014. – 750б.
2. Сеитов З.С. Биохимия : Оқулық / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б
3. Сейтембетов Т.С. Биологиялық химия : оқулық / Т. С. Сейтембетов, Б. И. Төлеуов, А. Ж. Сейтембетова. - Алматы : Эверо, 2011. - 420 б. : сур.
4. Биохимия сұрақтары мен жауаптары = Биохимия в вопросах и ответах : оқу құралы / құраст. Т. С. Сейтембетов [и др.]. - Алматы : Эверо, 2010. - 312 б
5. Сейтембетов Т.С. Биологиялық химия : Оқулық / Сейтембетов, Талғат Сұлтанұлы, Төлеуов Б.И., Сейтембетова А. Ж. - Карағанды, 2007. - 426 с
Бақылау:зерттеу әдістерінің орындалу сапасын, құралдармен жұмыстаудың практикалық дағдыны бағалау
Құралдар: приборлар (ФЭК АР – 101, ФЭК - 02, термостат ТСО 1/80, су моншасы, ультрадыбыстық жуғыш, рН-метр 150м, рН-метр С830Р спектрофотометр, зертханалық таразы SPU 401,торсиондық және аналитикалық таразы, центрифугалар, дистиллятор АДЭ – 5, компьютерлер.
Жабдықтар: реактивтер жиыны, зертханалық химиялық ыдыс, штативтер, белоктарды және амилазаны анықтауға арналған реактивтер.
Биурет реакциясы.
Принципі. Белоктағы пептидбайланысын биуретан реакиясы арқылы ашуға болады. Сілтілік ортада белоктар мен мыс иондары әрекеттесіп күлгін – көк түсті боялады. Ал төменгі малекулалық белоктар қызғылт түске боялады. Мыс мен белоктың құрамындағы пептид байланысы арқылы түзілген биуретан комплексі нәтижесінде биуретан реакциясы жүреді.
Жұмыс жолы. 5 тамшы күйдіргіш натрий ертіндісіне 5 тамшы белок ертіндісін және 1 тамшы мыс мульфаты ертіндісін құямыз. Осы қоспаны пробиркада сілкиміз сонда ертінді қызыл – көгілдір түске боялады.
Ферментативтік реакциялардың рН ортаға тәуелділігі.
Себебі.Жұмыс фермантативтік реакциялардың реттелуінің кейбір механизмдерін тәжірибе жүзінде анықтауға болатынын дәлелдейді.
Реактивтер.
1. Тұз қышықылының 10 % - тік ертіндісі.
2. Натрий сілтісінің 10 % -тік ертіндісі.
3. 1 % - тік крахмал ертіндісі, люголь ертіндісі.
Принципі.Әр ферменттің өзіне тән оптиумум рН – ы бар. Яғни рН- тың белгілі бір шамасында ол активті бола алады. Бұл байланыс тың табиғатында ферменттердің белоктардан тұратындығы жатады. Ионоген топтарының иондау дәрежесі рН- тың шамасына байланысты өзгертеді, сондықтан активті центрдің конфармациясы өзгереді, ал бұл ферменттің активтілігін көрсетеді. Бұл жұмыс сілекей құрамындағы амилазаның активтілігін әртүрлі рН сандарына негізделген. Активтілік критериі ретінде амилазаның белгілі бір уақыт аралығындағы азаюы арқылы анықталады.
Жұмыс жолы.
1. Сілекей жұмысшы ертіндісін дайындау. 1 мл сілекейге 9 мл дист.су қосылады.
2. Нөмірленген үш пробиркаға сілекейдің (1:10) жұмысшы ертіндісінен 10 тамшыдан қосамыз.
3. 2 – ші пробиркаға 1 тамшы НСI ертіндісін, 3 – ші пробиркаға NaOH ертіндісін қосамыз.
4. Барлық пробиркаға 10 тамшыдан 1 % - тік крахмал ертіндісін құямыз.
5. 5 мин. Су моншасында қыздырамыз, 45 ˚С – та барлық пробиркаға Люголя ертіндісінің 3 тамшысын қосамыз, бірінші пробиркадағы ерітінді сары түске боялады, ал 2 мен 3пробиркаларда көк түске боялады.
Жұмыстың орындалу жолы.
| Пробиркалар Реактивтер | |||
| Сілекейдің жұмысшы ерітіндісі 10 там 10 там 10 там | |||
| НСI ерт. - 1 - | |||
| NaOH ерт. | |||
| 1 % - тік крахмал ерт 10 там 10 там 10 там |
6. Жұмыстан шыққан нәтижелерді таблицаға түсіру. Лабороториялық жұмысқа есеп «Ферментативті реакциялардың рН - артаға тәелділігі»
| Пробирканың № | Субстрат | Фермент | рН –ның ортаның | Люголя ертіндісін қосқаннан кейінгі ертіндінің түсі |
Қорытынды.
Белоктардың денатурациясы
Себебі. Денатурацияның болуы ауыр металдардың тұздарымен улану және химиялық термиялық күйю болып табылады, сондай- ақ белоктардың денатурациясына әр түрлі дәрілік препараттардың және тамақ технологияларының дайындалкуы негізделген.
Реактивтер.
1. Жұмыртқа белогының 1% ертіндісі.
2. Күкірт қышқыл мыстың 1% - тік ертіндісі.
3. Күкірт қышқыл күмістің 1% - тік ертіндісі.
4. Сірке қышықыл қарғасының 5% - тік ертіндісі.
5. Тұз қышқылының қою ертіндісі.
6. Күкірт қышқылының қою ертіндісі.
7. Азот қышқылының қою ертіндісі
8. Үш хлорсірке қышқылының 10 % - тік ертіндісі.
9. Сульфоцалин қышқылының 10 % - тік ертіндісі.
10. Сірке қышықылының 10% - тік ертіндісі.
11. Танинның қаныққан ертіндісі.
12. Сірке қышықылының 1% - тік ертіндісі.
13. Натрий сілтісінің 1% - тік ертіндісі.
Белоктың денатурациясы дегеніміз қайтымсыз процесс, яғни белоктардың конформациясы бұзылады, физика – химиялық қасиеттері өзгереді, (суда ерігіш өасиеті) биологиялық қасиеті, қызметі жоғалады.
Ауыр металдардың тұздарымен белоктардың денатурациялануы.
Принципі.Белоктардың денатурациялық механизмы аминқышықылды радикалдарымен ауыр – металдардың иондарымен ерекше әрекеттесуінің қабілеттілігіне негізделген. Сонымен тұзға ұқсас комплексті пайда болып тұнбаға түседі.
Белоктарды ауыр металдардың тұздарымен тұнбаға түсіру тұздауға қарағанда, тұздардың аз қойылтылған ерітіндісне өтеді. Кейбір тұздардың артық мөлшері тұнбаны ерітеді(жеке алғанда қорғасынмен мыс тұздарын, бірақ күміс тұздарын емес).Белоктардың бөлшектері ауыр иондарды бетіне сіңіргендіктен біртектес иондар пайда болады.
Ауыр металлдардың тұздарымен уланғанда белок олардығ иондармен байланысып сіңірілуін шектейді мысалы (жұмыртқа мен сүттің белоктары ) белок ауыр металдар иондармен ерімейтін комплексті қосылыстар түзеді.
Жұмыс жолы.
1. Үш пробиркаға 5 мл белок ертіндісін құямыз
2. Бірінші пробиркаға 1 тамш 5% - ті күміс нитратын, екінші пробиркаға 1 тамшы 5%-мыс сульфатын, үшінші пробиркаға 1 тамшы 5% қорғасын ацетатының ертіндісін құямыз. Ертінділердің лайлануы белоктың бар екенін көрсетеді.
3. Ал тұз ертінділерінің артық мөлшерін қоссақ 1 – ші пробиркадағы лай сол күйінде қаладыда, 2 – ші мен 3 – ші пробиркадағы лай қайтадан еріп мөлдірленеді, яғни белоктардың комплексті тұздары қайтадан ериді.
Минералды қышқылдардың қойылтылған ертіндісі арқылы белоктың денатурациялануы.
Принципі.Белоктың денатурациясы дегидратация немесе комплексті тұздардың түзілуі нәтижесінде жүзеге асады, Минералды қышықылдардың артық мөлшерінде (HNO2) денатурацияға ұшыраған белоктар қацтадан ериді, себебі гидролизге не белоктың зариядының өзгеоуіне байланысты болуы керек.
Жұмыс жолы.
1. Үш пробиркаға 15 тамшы қойылтылған тұз қышықылының, азот қышқылының ертінділерін құяды.
2. Барлық пробиркаға белоктың тең көлемін абайлап құяды. Пробиркада екі қабат сұйық пайда болады. Оның шекарасында ақ дөңгелек сақина пайда болады, бұл белоктың денатурацияға қшыраған белгісі болып табылады. Пробирканы сілкіпжібергенннен кейін 1 – ші мен 2 – ші пробиркаларда тұнба ериді, ал 3 – ші пробиркада тұнба ерімей қалады.
Органикалық қышқылдармен белоктың денатурациялануы.
Принципі.Белоктың денатурациясы оның дегидрациясы мен зарядтың өзгеруіне байланысты.
Сульфацалин қышқылы полипептидтерге, белоктарға сезімтал реактив болып табылады. Зәрдегі белокты анықтау әдісісульфацалин қышқылының реакциясына негізделген. Үш хлорлысірке қышықылы тек белоктарды тұнбаға түсіреді, сондықтан клиникалық – биохимиялық аналаиздерде кең қолданылады.
Жұмыс жолы.
1. Екі пробиркаға 10 тамшыдан белок ертіндісін құяды.
2. Бірінші пробиркаға екі тамшы 10 % үшхлорсірке қышқылының ертіндісін қосады 2 – ші пробиркаға 1 тамшы 10% Сульфацалин қышқылын құяды. Ертінідінің лайлануы белоктың бар екендігін көрсетеді.
«Алколойдты» реактивтер мен белокты денатурациялау.
Принципі. Алколойдты реактивтер аминоқышқыл қалдықтарындағы радикалдың гетероциклды топтарымен әрекеттесе отырып денатурацияға ұшырайды. Осының әсерінен тұз тәріздес қосылыстар түзіледі, белок катион, Алколойдт реактиві – анион ретінде кезігеді. Сондықтан толық тұнбаға түсуі қышқыл ортада жүреді.
Күйген жерге танинмен әрекеттемтіре ол белокты денатурацияға ұшыратады да қорғаныш қабатын түзеді, ал бұның нәтижесінде тканнің сусыздануымен инфекцияға ұшырау қауіпсіздігі туады.
Жұмыс жолы.
1. 2 пробиркаға 2 мл белок ертіндісін құяды.
2. 3 тамшыдан 10% сірке қышықылын қосады.
3. 1- ші пробиркаға тамшылап танин ертіндісін, 2- ші пробиркаға К3 [Fe)CN)6]қосады.Ертінідінің лайлануы белоктың тұнбаға түсуі.
Жылу денатурациясы.
Принципі.Сүтекті және гидрофобты байланыстардың үзілуі нәтижесінде жылу денатурациясы пайда болады. Изоэлектр нүктесінде белок тез жіне толығымен тұнбаға түседі. Өте күшті сілті және қышқыл ертінділерінде қыздыру арқылы денатурацияға ұшыраған белоктар тұнбаға түспейді, себебі заряд өзгереді немесе зарядтар ұлғаяды.
Жұмыс жолы:
1. Белоктың ертіндісін 2- мл – ден 4 пробиркаға құяды.
2. 2 – ші пробиркаға 1 тамшы 1% - ті сіркеқышқылы ертіндісін құяды, 4 –шіге 10 тамшы 10% - ті күйдіргіш натр ертінідісін құяды. Барлық ертіндісі бар пробиркаларды қыздырады. 1- ші 2- ші пробиркадағы ертінділер лайланады, ал 3 –пен 4 – ші пробиркадаңы ертінділер лайланбай мөлдір түрінде қалады, себебі 1 – ші жағдайда белоктар тұнбаға түсті.
α – АМИЛАЗА - ВИТАЛ
Қан сарысуында (плазмада) және несепте α – АМИЛАЗа белсенділігін энзимді кинетикалық әдіспен анықтау үшін реагенттер жинағы
α – АМИЛАЗА-02 ВИТАЛ Кат. № В 11.02
α – АМИЛАЗА -12 ВИТАЛ Кат. № В 11.12
α – АМИЛАЗА 22 ВИТАЛ Кат. № В 11.22
Реагенттер жинағы халықаралық талаптарға сәйкес жинақталған «Витал- FL-E» сериясына жатқызылады. Әдіс рефератты болып табылады.
Әдістің принципі:
α – амилаза әсерінен синтетикалық субстрат EPS [4,6 этилиден (G7) -п-нитрофенил(G1)-α,D-мальтогептаозид] түссіз нитрофенилмальтоозидтер түзіп гидролизденеді. α – глюкозидаза әсерінен нитрофенилмальтоозидтер глюкоза және бояулы п- нитрофенолға дейін гидролизденеді. п-нитрофенол концентрациясының жоғарылау жылдамдығы фермент белсенділігіне пропорционал болады.
Зерттелетін материал:
Жаңадан жиналған қан сарысуы /плазмасы немесе несеп ( цитратсыз, оксалатсыз, фторидтерсіз, ЭДТА).
Жинақтың құрамы:
Реагент № 1. Буфер
HEPES………………………………100ммоль/л,рН7,1
NaCl…………………………………..50ммоль/л
MgCl2…………………………………………………..10ммоль/л
α –глюкозидаза………………………2 500 U/л
Реагент № 1. Субстрат
EPS…………………………………...5ммоль /л
Жинақтың аналитикалық сипаттамалары:
Тараптар бойынша ---------------------------------- до 1320ед/л
Вариация коэффиценті мәні---------------------------------- 5 % артық емес
Инкубация уақыты -------------------------------------------- 2 мин +0,3- 3,0 мин
Инкубация температурасы ………………………………25°С,30°С или 37°С
Анализ үшін реагенттерді дайындау және олардың тұрақтылығы:
Жинақтың сақталу мерзімі – 2 -8оС 18 ай. Дайындалған күні, каталог бойынша сериясы және номері қаттамада көрсетілген.
Жұмысшы реагент:
анализ жүргізудің алдында №1 және №2 реагенттерді қажетті мөлшерде 4+1 қатынасында араластырады. Алынған реагентті 2- 8 °С температурада 10 күн тұрақты сақтауға болады. Пайдаланып болғаннан кейін құтының аузын тығыздап жабу қажет.
АНАЛИЗ
Фотометрия: кювета -1см, λ=405 нм. Су немесе жұмысшы реагентке қарсы. Жұмысшы реагентті анализді жүргізу температурсына дейін қыздыру керек.
Жұмысшы реагент пен зерттелетін үлгі келесі қатынаста араластырылады:
Қан сарысуы/плазма:100+4, мысалы 1,0 мл реагент + 0,04 мл үлгі.
Несеп:100+2, мысалы 1,0 мл реагент +0,02 мл үлгі.
Мұқият араластырылады және қажетті температурада ( 37°С –да 2 мин немесе 25/30°С-да 3 мин)инкубациялайды.Бастапқы экстинкцияны өлшейді және соңғы 3 минут ішіндегі әрбір 1 минуттағы (Д/Е мин) экстинкция өзгерісін анықтайды. (Автомат анализаторларда жұмыс істеген кезде қысқы уақыт аралығындағы, мысалы, 20 секундта экстинкцияны анықтауға болады, кезекті автоматты есептеу Д\Е мин.)
α – амилаза белсенділігі келесі формула бойынша есептеледі:
Қан сарысуы/плазма: Белсенділігі * [ед/л ] = 2476 ×ДЕ/мин немесе [нмоль/с×л] = 41275 ×ДЕ /мин *1U/л = 16,67 нмоль(с.л)
Несеп: Белсенділігі * [ед/л ] = 6067 × ДЕ/мин немесе [нмоль/с×л] =101137 × ДЕ/мин
*Қалыпты мәндері:
| 25°С | 30°С | 37°С | |
| Қан сарысуы/плазма | 60ед/л | 80ед/л | 110ед/л |
| 1000нмоль/схл | 1334 нмоль /схл | 1835 нмоль/схл | |
| несеп | 600ед/л | 800 ед/л | 1000ед/л |
| 10 000 нмоль /схл | 13 300 нмоль /схл | 16 670 нмоль /схл | |
| несеп /24 сағат | 450 ед/л | 650 ед/л | 900 ед/л |
| 7 500 нмоль /схл | 10 840 нмоль /схл | 15 000 нмоль /схл |
*Әрбір зертханада тексеруден өтетін адамдар үшін қалыпты мәндері диапазон ын нақтылау ұсынылады.
Назар аударыңыз: реагенттің сілекей немесе терімен ластанбауы үшін құтыдан α-амилазны ауызбен сорып жинауға болмайды. Құтыны ашқан кезде маска және резина қолғап кию керек.
Назар аударыңыз: Белсенділікті есептеу коэффиценті әртүрлі серияда α – глюкозидаза ферменті қасиетіне байланысты ауытқуы мүмкін. Әрбір жинақтағы сипаттаманы мұқият оқыңыз.
α –амилазы белсенділігін анықтаудың дұрыстығы «Precionorm U & Precipath U»(Roche Diagnostics,Германия) бақылау сарысулары көмегімен тексерілген және бекітілген.
«Витал Дагностикс СПб»Санкт – Петербург, Россия 194156, пр. Энгельса,27, корп.12В.
Тел.8-800-200-23-24 (812)293-21-32,(812)293-23-24.Факс (812)326-61-98
2-ші сабақ
Тақырыбы: Зертханалық практикум: «Витаминдер»
Мақсаты: Биологиялық сұйықтықтардағы витаминдердің сандық мөлшерін анықтаудың клиникалық диагностикалық маңыздылығын көрсету.
Сабақтың міндеттері:
· витаминдерді анықтау әдістерін оқыту.
Тақырыптың негізгі сұрақтары:
1. В1 витаминін (тиамин) анықтау әдісі
2. В6 витаминін (пиридоксин) анықтау әдісі
3. С витаминін (аскорбин қышқылы) анықтау әдісі
4. Зерттеу нәтижелерін тіркеп жазу
5. Алынған нәтижелерді талдау
Оқыту және үйрету әдістері: биохимиялық әдістерді өткізу, хаттаманы құрастыру, алынған нәтижелерді талдау (TBL)
Әдебиет:
1. Биохимия: Оқулық (5 шығарылым) Северин Е.С. редакциясы, аударма Сейтембетова А.Ж. . – М.: ГЕОТАР-МЕД., 2014. – 750б.
2. Сеитов З.С. Биохимия : Оқулық / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б
3. Сейтембетов Т.С. Биологиялық химия : оқулық / Т. С. Сейтембетов, Б. И. Төлеуов, А. Ж. Сейтембетова. - Алматы : Эверо, 2011. - 420 б. : сур.
4. Биохимия сұрақтары мен жауаптары = Биохимия в вопросах и ответах : оқу құралы / құраст. Т. С. Сейтембетов [и др.]. - Алматы : Эверо, 2010. - 312 б
5. Сейтембетов Т.С. Биологиялық химия : Оқулық / Сейтембетов, Талғат Сұлтанұлы, Төлеуов Б.И., Сейтембетова А. Ж. - Карағанды, 2007. - 426 с
Бақылау: зерттеу әдістерінің орындалу сапасын, құралдармен жұмыстаудың практикалық дағдыны бағалау
Құралдар: приборлар (ФЭК АР – 101, ФЭК - 02, термостат ТСО 1/80, су моншасы, ультрадыбыстық жуғыш, рН-метр 150м, рН-метр С830Р спектрофотометр, зертханалық таразы SPU 401,торсиондық және аналитикалық таразы, центрифугалар, дистиллятор АДЭ – 5, компьютерлер.
Жабдықтар: реактивтер жиыны, зертханалық химиялық ыдыс, штативтер, В1, В6 және С вистаминдерін анықтауға арналған реактивтер.
В6 (пиридоксин) витамині үшін реакия.
Принципі. В6 витамині темір хлоридімен әрекеттесу нәтижесінде ол қызыл түске боялады, себебі темірдің феноляты деп аталатын қызыл түсті комплексті қосылыс түзіледі.
Жұмыс жолы. 5 тамшы 5% - тік пирдоксин ертіндісін 1 тамшы 5 % - тік FeCI3 пробиркада араластырамыз сілку нәтижесінде қызыл түске боялады.
РР (никотин қышқылы) витамині үшін реакция.
Принципі.Мысытың ацетатымен никотин қышықылының ертіндісін қызыдырғанда көк түсті тұнба түзеді мыстың тұзында нашар еритін.
Жұмыс жолы. Пробиркадағы 10 % - ті тамшы сірке қышқылына 5 мг никотин қышқылын қосамыз. Қыздырылған ертіндіге тең көлемде 5% - сірке қышқылының мысын қосады. Сұйық көк түске боялады, біраз тұрғаннан соң никотин қышқылының тұзы көк түсті тұнбаға түседі.
С витаминінің реакциясы (аскорбин қышқылы)
Принципі. Бұл реакция аскорбин қышқылының тотығуы мен К3 [Fe)CN)6]: 3Н2О түзілуі, ең соңғысы хлорлы темір мен берлинді лазурь түзеді.
Жұмыс жолы. Пробиркада 1 тамшы 5 % - тік синеродисті калий ертіндісін 1 тамшы 1 % - тік хлорлы темір ертіндісін және 5 тамшы 1 % - тік қоймалжың томат шырынын араластырамыз. Сұйық жасыл – көк болып, көк тұнбаға түседі
КРЕДИТ
3-ші сабақ
Тақырыбы: Зертханалық практикум: «Көмірсулар алмасуы»
Мақсаты: биологиялық сұйықтықтарда көмірсулар алмасуы метаболиттерінің сандық мөлшерін анықтаудың клиникалық диагностикалық маңызын көрсету
Сабақтың міндеттері:
· биологиялық сұйықтықтарда глюкозаны анықтау әдістерін үйрету
Основные вопросы темы:
1. Қан сарысуында глюкозаны анықтау әдістері
2. Несепте глюкозаны анықтау әдістері
3. Глюкоза толеранттық тесті жүргізудің сызбанұсқасы
4. Несепте ПЖҚ анықтау әдістері
5. Қан сарысуында глюкозаны анықтау әдістері
6. Несепте глюкозаны анықтау әдістері
7. Глюкоза толеранттық тесті жүргізудің сызбанұсқасы
8. Зерттеу нәтижелерін тіркеп жазу
9. Алынған нәтижелерді талдау
Оқыту және үйрету әдістері: биохимиялық әдістерді өткізу, хаттаманы құрастыру, алынған нәтижелерді талдау (TBL)
Әдебиет:
1. Биохимия: Оқулық (5 шығарылым) Северин Е.С. редакциясы, аударма Сейтембетова А.Ж. . – М.: ГЕОТАР-МЕД., 2014. – 750б.
2. Сеитов З.С. Биохимия : Оқулық / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б
3. Сейтембетов Т.С. Биологиялық химия : оқулық / Т. С. Сейтембетов, Б. И. Төлеуов, А. Ж. Сейтембетова. - Алматы : Эверо, 2011. - 420 б. : сур.
4. Биохимия сұрақтары мен жауаптары = Биохимия в вопросах и ответах : оқу құралы / құраст. Т. С. Сейтембетов [и др.]. - Алматы : Эверо, 2010. - 312 б
5. Сейтембетов Т.С. Биологиялық химия : Оқулық / Сейтембетов, Талғат Сұлтанұлы, Төлеуов Б.И., Сейтембетова А. Ж. - Карағанды, 2007. - 426 с
Бақылау: зерттеу әдістерінің орындалу сапасын, құралдармен жұмыстаудың практикалық дағдыны бағалау
Құралдар: приборлар (ФЭК АР – 101, ФЭК - 02, термостат ТСО 1/80, су моншасы, ультрадыбыстық жуғыш, рН-метр 150м, рН-метр С830Р спектрофотометр, зертханалық таразы SPU 401,торсиондық және аналитикалық таразы, центрифугалар, дистиллятор АДЭ – 5, компьютерлер.
Жабдықтар: реактивтер жиыны, зертханалық химиялық ыдыс, штативтер, компьютерлік анимациялар, тест тапсырмалар, ситуациялық тапсырмалар. глюкозаны анықтауға арналған реактивтер.
ГЛЮКОЗА – ВИТАЛ
Биологиялық сұйықтықтардағы глюкоза концентрациясын энзимді колориметриялық әдіспен анықтау үшін реагенттер жинағы
ГЛЮКОЗА – 02 ВИТАЛ Кат. № В 05.02
ГЛЮКОЗА – 12 ВИТАЛ Кат. № В 05.12
ГЛЮКОЗА – 32 ВИТАЛ Кат. № В 05.32
Реагенттер жинағы халықаралық талаптарға сәйкес жинақталған « Витал -Европа» сериясына жатқызылады.
Әдістің принципі:
D-глюкоза оттегімен глюкозооксидаза әсерінен тотыққан кезде эквимолярлы мөлшерде сутегі асқын тотығы түзіледі. Сутегі асқын тотығы хромогенды субстраттарды пероксидаза ферменті әсерінен бояулы өнімдер түзе тотықтырады. Бояудың қанығу дәрежесі сынамадағы глюкоза концентрациясына пропорционал болады.
Зерттелетін материал:
Жаңадан жиналған қан сарысуы /плазмасы немесе несеп. Несепте алдын ала сапалық реакция жүргізген дұрыс, ал сандық зерттеулерді оң реакция беретін сынамаларда ғана жүргізеді.
Жинақтың құрамы:
Реагент № 1. Буфер
Фосфатный буфер, Рн 7,5----------------------------- 150 ммоль/л
Фенол -------------------------------------------------------10 ммоль/л
Реагент № 2. Лиофилизат
Глюкозооксидаза--------------------------------------- 25000 ед/л
Пероксидаза---------------------------------------------- 1500 ед/л
Калибратор
Глюкоза -------------------------------------------------- 10 ммоль/л
Жинақтың аналитикалық сипаттамалары:
Тараптар бойынша ---------------------------------- 30 ммоль/л реагент/ үлгі 200/1 дейін
20 ммоль/л / үлгі 100/1 дейін
Вариация коэффиценті мәні---------------------------------- 5 % артық емес
Инкубация уақыты -------------------------------------------- 20-25оС – 15 мин; 37 оС – 10 мин.
Сезімталдығы -------------------------------------------------- 0,5 ммоль/л
Бояудың қанымдылығы ------------------------------------- 1 сағаттан кем емес.
Анализ үшін реагенттерді дайындау және олардың тұрақтылығы:
Жинақтың сақталу мерзімі – 2 -8оС 18 ай. Дайындалған күні, каталог бойынша сериясы және номері қаттамада көрсетілген. Ашылмаған реагент № 1 және калибратор
18-25 оС; реагент № 2 2-8 оС жағдайда 18 айға дейін сақталады.
Жұмысшы реагент:
№ 2 құтының құрамын № 1 құтының құрамымен мұқият араластырып ерітеді. Оптималды нәтижелер алу үшін лиофилизат толық ерігеннен соң жұмысшы реагентті бөлме температурасында 20 – 30 минут ұстау керек. Алынған реагентті 2 - 8°С температурада 6 айға дейін тұрақты сақтауға болады. Пайдаланып болғаннан кейін құтының аузын тығыздап жабу қажет. Сақталу кезіндегі реагенттің қызғылт түске боялуының глюкозаны анықтау нәтижесіне әсері болмайды ( оптикалық тығыздығы сумен салыстырғанда 0,200, кювета – 1 см).
Калибратор пайдаланылуға дайын. Ашылып пайдаланылған калибратор құтының аузы тығыз жабылған жағдайда 6 айға дейін тұрақты сақталады.
А Н А Л И З
Сапалық реакция: 0,5 млжұмысшы реагентке 0,01 мл несеп қосады. Егер 15 минуттан кейін қызғылт бояу пайда болатын болса, онда сынама оң деп есептеледі және глюкозаны сандық анықтау үшін қолдануға болады.
Сандық анализ:
| Пробирка құрамы | Тәжірибелік сынама мл | Калибрлік сынама мл | Бақылау сынама,мл |
| Қан сарысуы/плазма немесе несеп | 0,01 | - | - |
| Жұмысшы реагент | 2,0 | 2,0 | 2,0 |
| калибратор | - | 0,01 | - |
Реакциялық қоспаны мұқият араластырады және 37 оС температурада 10 минут немесе бөлме температурасында 15 минут ұстайды. Содан кейін тәжірибелік және калибрлік сынамалардың оптикалық тығыздығын бақылау сынамасына қарсы анықтайды, шағылыстыру қабатының қалыңдығы 5мм кювета пайдаланылады және толқын ұзындығы 510 нм (ФЭК – 490 нм).
Бояуы тікелей күн сәулесі түспеген жағдайда инкубациядан соң бір сағат уақытқа дейін тұрақты болады.
Глюкоза концентрациясы келесі формула бойынша есептеледі: С=Еоп/Екал х 10,
ЕОП және ЕКАЛ – бақылау сынамасымен салыстырмалы өлшенген тәжірибелік және калибрлік сынамалар экстинкциялары.
Қалыпты мәндері: қан сарысуы/плазма – 4,2 – 6,1 ммоль/л; несеп – 0,8 ммоль/л
Назар аударыңыз: 1.Гемоглобиннің 0,124ммоль/л және билирубиннің 324 мкмоль/ дейінгі гемолизінің глюкозаны анықтау нәтижесінің дұрыстығына әсері болмайды 2. Қажет болған жағдайда үлгінің көлемін 0,02 мл дейін жоғарылатуға болады (тараптар бойынша 20ммоль дейін) немесе алдын ала физиологиялық ерітіндімен екі есе сұйытылған 0,02 мл үлгі (тараптар бойынша 30 ммоль дейін) пайдаланылады 3. Анализ үшін пайдаланылатын ыдыстарды және кюветаларды тазалап жуған кезде құрамында сутегі асқын тотығы, сонымен қатар күкіртті эфир бар жуғыш құралдарды (мысалы, Никифоров қоспасын) қолдануға болмайды.4.Биохимиялық анализаторлардың бағдарламаларын сұрап алуға болады.
Глюкоза концентрациясын анықтаудың дұрыстығы «Precionorm U & Precipath U»(Roche Diagnostics,Германия) бақылау сарысулары көмегімен тексерілген және бекітілген.
«Витал Дагностикс СПб»Санкт – Петербург, Россия 194156, пр. Энгельса,27, корп.12В.
Тел.8-800-200-23-24 (812)293-21-32,(812)293-23-24.Факс (812)326-61-98
Лактатқа сапалық реакциялар
Себебі: Бұл тажірибе жүзінде глюкогенолиз бен глюколиздің ақырғы өнімі лактатты анықтауға болады. Қағида: Күлгін түсті темір фенолятының қатысуымен қышқылы сары – жасыл түсті темір лактатын түзеді.(Уфельман реакциясы)
Жұмыс жолы: Пробиркаға 1 мл жуық уфельман реактивын құямыз, (20тамшы 1% - ті фенол ертіндісі + 2 тамшы 1% хлорлы темір ертіндісін күлгін түс пайда болғанға дейін құямыз).
Ертіндіге тамшылатып бұлшық етті экстракт құямыз, егер сүт қышқылы болса ерітінді сары – жасыл түске боялады, соңынан сүт қышқылды темір түзіледі.
Қорытынды.
Несептегі прожүзім қышқылының мөлшерін анықтау.
Себебі:Несептің пирожүзім қышқылының мөлшерін анықтау әдісі ауруларды емдеу және диагностика үшін маңызы зор. Тәулігіне несеппен бірге 113,7-283,9 мкмоль/тәулік пирожүзім қышқылы бөлінеді.Реактивтер: 2,5% - ті КОН – тың спиртті ертіндісі, 0,1% - ті 2,4 ДНФГ ертіндісі.
Қағида: Пирожүзім қышқылы сілтілік ортада 2,4 ДНФГ – мен әрекеттескенде 2,4 динитрофенил гидрозон түзеді, пирожүзімнің бояуы сары – жасыл түске боялады. Бояу жылдамдығы пирожүзім қышқылының концентрациясына пропорционал болады.
Жұмыс жолы: Жұмыс барысы жүйе жүргізіледі:
| Реактивтер | Бақылау | Тәжірибе |
| Несеп - 1,0 Н2О 1,0 - 2,5% - тіт КОН спирт Ертіндісі 1,0 1,0 | ||
| 1 минут араластыру керек | ||
| 0,1% 2,4 ДНФГ ертіндісі 0,5 0,5 |
Араластырғаннан кейін 15 минут бөлме темпиратурасында қалдырамыз. ФЭК- те колориметрлейді бақылауға қарсы қойып өлшейміз. Кювета 5,0 көгілдір жарық сүзгі (490нм).
Клиникалық – диагностикалық маңызы.
ПЖК – көмірсулардың дихотомикалық ыдырауының маңызды интермедиаты.
ПЖК – ның мөлшері организмдегі В1 витаминнің қаныққандығын көрсететін ақпарат көрсеткіш болып табылады. ПЖК мөлшерінің күрт артуы бұлшық еттердің қызыметінің көбеюі мен В1 витаминнің жеткіліксіздігінің айғағы болып табылады.Сонымен қатар осы ПЖК – ның мөлшерінің қан сарысуында көбеюі гепатит (сары ауру),қант диабеті және жүректің кейбір аурулары кезінде байқалады.
ЖҮЙЕ
Несептегі ПЖК мөлшерін анықтаудағы қорытынды.
| № | Студенттердің аты - жөні | Жынысы | Несептегі ПЖҚ мкмоль/тәулік | Қорытынды баға |
4-ші сабақ
Тақырыбы: Зертханалық практикум: «Липидтер алмасуы»
Мақсаты: биологиялық сұйықтықтарда липидтер алмасуы метаболиттеріннің сандық мөлшерін анықтаудың клиникалық диагностикалық маңыздылығын көрсету
Сабақтың міндеттері:
· биологиялық сұйықтықтарда липидтер алмасуы метаболиттерінің мөлшерін анықтау әдістерін үйрету (қан сарысуында)
· липидтік алмасудың интерпретация ережесін оқыту
Тақырыптың негізгі сұрақтары:
1. Қан плазмасында қалыпты және патологиялық жағдайлардағы холестериннің және ТАГ сандық мөлшерін анықтау
2. Биологиялық сұйықтықтарда қалыпты және патологиялық жағдайлардағы пре – бета липопротеиндердің белсенділігін анықтау
3. Несепте кетондық денелердің мөлшерін анықтау
4. Зерттеу нәтижелерін тіркеп жазу
5. Жұмыс нәтижелерін талдау
Оқыту және үйрету әдістері: биохимиялық әдістерді өткізу, хаттаманы құрастыру, алынған нәтижелерді талдау (TBL)
Әдебиет:
1. Биохимия: Оқулық (5 шығарылым) Северин Е.С. редакциясы, аударма Сейтембетова А.Ж. . – М.: ГЕОТАР-МЕД., 2014. – 750б.
2. Сеитов З.С. Биохимия : Оқулық / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б
3. Сейтембетов Т.С. Биологиялық химия : оқулық / Т. С. Сейтембетов, Б. И. Төлеуов, А. Ж. Сейтембетова. - Алматы : Эверо, 2011. - 420 б. : сур.
4. Биохимия сұрақтары мен жауаптары = Биохимия в вопросах и ответах : оқу құралы / құраст. Т. С. Сейтембетов [и др.]. - Алматы : Эверо, 2010. - 312 б
5. Сейтембетов Т.С. Биологиялық химия : Оқулық / Сейтембетов, Талғат Сұлтанұлы, Төлеуов Б.И., Сейтембетова А. Ж. - Карағанды, 2007. - 426 с
Бақылау: зерттеу әдістерінің орындалу сапасын, құралдармен жұмыстаудың практикалық дағдыны бағалау
Құралдар: приборлар (ФЭК АР – 101, ФЭК - 02, термостат ТСО 1/80, су моншасы, ультрадыбыстық жуғыш, рН-метр 150м, рН-метр С830Р спектрофотометр, зертханалық таразы SPU 401,торсиондық және аналитикалық таразы, центрифугалар, дистиллятор АДЭ – 5, компьютерлер.
Жабдықтар: реактивтер жиыны, зертханалық химиялық ыдыс, штативтер, тест тапсырмалар, ситуациялық тапсырмалар. пре – бета липопротеиндердің белсенділігін және кетондық денелерді анықтауға арналған реактивтер.
ЛИПИДТЕРДІҢ АЛМАСУЫ
ҚАН САРЫСУЫНДАҒЫ 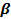 -ЖӘНЕ ПРЕ
-ЖӘНЕ ПРЕ 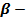 ЛИПОПРОТЕЙНДЕРДІҢ МӨЛШЕРІН ТУБИМЕТРИКАЛЫҚ ӘДІСПЕН АНЫҚТАУ.
ЛИПОПРОТЕЙНДЕРДІҢ МӨЛШЕРІН ТУБИМЕТРИКАЛЫҚ ӘДІСПЕН АНЫҚТАУ.
Себебі.Бұл тубиметрикалық әдістің қан сарысуындағы  -және пре
-және пре  липопротейндердің мөлшерін анықтау диагностикалық және көрдеген аурулардың емдеу барысын бақылау үшін маңызы зор. Қан сарысуында
липопротейндердің мөлшерін анықтау диагностикалық және көрдеген аурулардың емдеу барысын бақылау үшін маңызы зор. Қан сарысуында  -және пре
-және пре  липопротейндердің шартты мөлшері 35 – 55 болады.
липопротейндердің шартты мөлшері 35 – 55 болады.
Реактивтер: 0,625 ммоль/л кальций хлоридінің ертіндісі, активтілігі 1000 Бірлік 1 мл – дегі гепарин.
Қағида.Кальций хлоридімен гепариннің қатысуымен қан сарысуындағы белоктардың колойдтық  липопротейндер тұнбаға түседі. Лайлану дәрежесіне қарап, ондағы
липопротейндер тұнбаға түседі. Лайлану дәрежесіне қарап, ондағы  -және пре
-және пре  липопротейндердің концентрациясын білуге болады.
липопротейндердің концентрациясын білуге болады.
Жұмыс жолы.
1. Пробиркаға 2 мл кальций хлоридін және 0,2 мл қан сарысуын құйып араластырамыз.
2. Ертіндінің оптикалық тығыздығын тексеремі (Е1) 0,025 – ке қарсы ФЭК- те кальций хлоридінің қызыл сәулелі фильтрде (толық ұзындығы 720 нм).
3. Кюветадағы ертіндіні пробиркағаи құйып 0,04 мл гепаринді қосып, тура 4 минуттан кейін ертіндінің оптикалық тығыздығын өлшейміз. (Е2).
4. Концентрацияны формула бойынша есептейміз.
С=(Е2 - Е1 )  100
100
Мұндағы 100 – эмприкалық коэфицент.
Клиникалық – диагностикалық маңызы.
Қан сарысуының құрамындағы  -және пре
-және пре  липопротейндердің мөлшерінінің көбеюі қандағы холестериннің көбеюімен тығыз байланысты.
липопротейндердің мөлшерінінің көбеюі қандағы холестериннің көбеюімен тығыз байланысты.  -және пре
-және пре  липопротейндердің көбеюі мынандай аурулар кезінде байқалады: атерослероз, бауырдың созылмалы аурулары, диабет, ксантомоз ауруларында. Ал азаюы
липопротейндердің көбеюі мынандай аурулар кезінде байқалады: атерослероз, бауырдың созылмалы аурулары, диабет, ксантомоз ауруларында. Ал азаюы  2 – плазмоцитома кезінде.
2 – плазмоцитома кезінде.
АЛЫНҒАН НӘТИЖЕЛЕРДІ ЖҮЙЕГЕ ТҮСІРУ КЕРЕК.
| р/с | Экстинция Е1 | Экстинция Е1 | Липопротейн 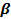 -және пре -және пре  – ның концент – ның концент
| Қорытынды баға |
Қан сарысуында триацилглицеридтердің жалпы концентрациясын энзиматикалық колориметрия әдісімен анықтау
Әдістің қағидасы:
Липаза әсерінен триацилглицеридтердің гидролизі кезінде май қышқылдары және глицерин түзіледі. Глицерокиназа әсерінен глицерин глицерол - 3 - фосфодқа айналады. Ол ауадағы оттегімен тотығып сутегінің асқын тотығын түзеді.Пероксидаза әсеріне сутегінің асқын тотығы хромогендік субстаттарды тотықтырып нәтижесінде бояулы өнім түзіледі. Бояудың қанықтығы сынамадағы триацилглицерид кщнцентрациясына пропорционалды болады.
Жұмыс барысы:
Үш пробиркаға 2,0 мл жұмысшы реагент қосады. Бірінші пробиркаға - тәжірибе сынамасына 0,02 мл қан сарысуын қосады. Екінші пробиркаға калибрлік сынамаға 0,02 мл калибратор қосады. Үшіншіге - бос сынамасына 0,02 мл дистелденген су қосады. Сынамаларды 5 мин. 37 С темперптурада сақтайды. Тәжірибелік және калибрлік сынамалардың оптикалық тығыздығын қалыңдығы 1,0 см кюветада 490-505нм жарық толқында анықтайды.
Есептеу:
(Е тәжірибе/Е кал х 2,85)-0,11 ммоль/л
Е тәжірибе - тәжірбиелік сынаманың экстинкциясы;
Е кал - калибрлік сынаманың экстинкциясы;
2,85 - калибратордағы триацилглицерид концентрациясы, ммоль/л;
Қалыпты мәндері:
Қалыпты мөлшері:0,14 - 1,82 ммоль/л;
Қуіпті топтың көрсеткіш мөлшері: 1,82-2,29ммоль/л;
Патологиялық мөлшер 2,29 ммоль/л;
Реагенттер жиынтығына инструкция.
Қан сарысуында холестериннің жалпы концентрациясын энзиматикалық колориметрия әдісімен анықтау.
Әдістің қағидасы:
Холестеролэстераза әсерімен холестерин эфирлерінің гидролизі кезінде бос холестерин түзіледі. Сынамада түзілген холестерин ауадағы оттегімен холестеролокидаза әсерімен тотығып сутегінің асқын тотыңы түзіледі. Пероксидаза әсеріне сутегінің асқын тотығы хромогендік субстаттарды тотықтырып нәтижесінде бояулы өнім түзіледі. Бояудың қанықтығы сынамадағы холестерин концентрациясына пропоционалды болады.
Жұмыс барысы:
Үш пробиркаға 2,0 мл жұмысшы реагент қосады. Бірінші пробиркаға - тәжірибе сынамасына 0,02 мл қан сарысуын қосады. Екінші пробиркаға калибрлік сынамаға 0,02 калибратор қосады. Үшіншіге - бос сынамасына 0,02 мл дистелденген су қосады. Сынмаларда 5 мин. 37 С температурада сақтайды. Тәжірбиелік және калибрлік сынамалардың оптикалық тығыздығын қалыңдығы 1,0 см кюветада 490-500 нм жарық толқында анықтайды.
Есептеу:
(Е тәжірибе/Е кал) х 5,17 ммоль/л
Е тәжірибе - тәжірбиелік сынаманың экстинкциясы;
Е кал - калибрлік сынаманың экстинкциясы;
5,17 - калибратордағы холестерин концентрациясы, ммоль/л;
Қалыпты мәндері:
Нақты мөлшері˂5,2 ммоль/л;
Қалыпты мөлшері:5,2 - 6,5 ммоль/л;
Патологиялық мөлшер˃6,5 ммоль/л;
Реагенттер жиынтығына инструкция.
5-ші сабақ
Тақырыбы: Зертханалық практикум: «Протеин және аминоқышқылдар алмасуы»
Мақсаты: қан плазмасында азоттық алмасуының метаболиттерін анықтаудың және асқазан сөлі анализінің клиникалық диагностикалық маңыздылығын көрсету..
Сабақтың міндеттері:
· Асқазан сөлі қышқылдылығын анықтау әдістерін үйрету
· Қан плазмасында трансаминазалар белсенділігін анықтау әдістерін үйрету
· Биологиялық сұйықтықтарда азоттық алмасу метаболиттері мөлшерін және ферменттер белсенділігін анықтаудың клиникалық диагностикалық маңызын түсіндіру
Тақырыптың негізгі сұрақтары:
1. Асқазан сөлі қышқылдылығын анықтау әдісі
2. Қан плазмасында мочевинаны анықтау әдісі
3. Қан плазмасында зәр қышқылын анықтау әдісі
4. Биологиялық сұйықтықтарда азоттық алмасу метаболиттерінің құрамын анықтаудың клиникалық диагностикалық маңызы
5. Зерттеу нәтижелерін тіркеп жазу
6. Алынған нәтижелерді талдау
Оқыту және үйрету әдістері: биохимиялық әдістерді өткізу, хаттаманы құрастыру, алынған нәтижелерді талдау (TBL)
Әдебиет:
1. Биохимия: Оқулық (5 шығарылым) Северин Е.С. редакциясы, аударма Сейтембетова А.Ж. . – М.: ГЕОТАР-МЕД., 2014. – 750б.
2. Сеитов З.С. Биохимия : Оқулық / З. С. Сеитов. - Алматы : Эверо, 2012. - 570 б
3. Сейтембетов Т.С. Биологиялық химия : оқулық / Т. С. Сейтембетов, Б. И. Төлеуов, А. Ж. Сейтембетова. - Алматы : Эверо, 2011. - 420 б. : сур.
4. Биохимия сұрақтары мен жауаптары = Биохимия в вопросах и ответах : оқу құралы / құраст. Т. С. Сейтембетов [и др.]. - Алматы : Эверо, 2010. - 312 б
5. Сейтембетов Т.С. Биологиялық химия : Оқулық / Сейтембетов, Талғат Сұлтанұлы, Төлеуов Б.И., Сейтембетова А. Ж. - Карағанды, 2007. - 426 с
Бақылау: зерттеу әдістерінің орындалу сапасын, құралдармен жұмыстаудың практикалық дағдыны бағалау
Жабдықтау: фотоэлектроколориметрлер/спектрофотометрлер, зертханалық ыдыстар, термостат, су моншасы, дозаторлар, қан сары суынан мочевина мен зәр қышқылын анықтау үшін жиынтықтар, асқазан сөлі қышқылдығын анықтау үшін реактивтер.
АМИНОҚЫШҚЫЛДАРДЫҢ ЖӘНЕ БЕЛОКТАРДЫҢ АЛМАСУЫ.
Асқазан сөлінің анализі
Асқазан сөлі түссіз қышқылды реакциясы /рН 1,5 – 2,5/ бар сұйықтық. Адам тәулігіне 1,5 л асқазан сөлін бөледі. Құрамына су, белоктар, ферменттер/пепсин, гастриксин/муцин, тұз қышқылы, қышқылға әсер ететін фосфат және басқа заттар кіреді, қышқылдық реакциясы тұз қышқылымен қышқылға әсерлі фосфаттың болуымен түсіндіріледі, патологиялық жағдайда сүт қышқылы мен ұшұыш май қышқылының болуына байланысты. Асқазан сөлінің әсерлі қышқылдарының жиынтығын жалпы қышқылдық деп атаймыз. Қорытылуға қатысатын тұз қышқылының байланыстыратын тұз қышқылы деп, ал қатыспайтынын бос тұз қышқылы деп атаймыз.
Аш қарында: қалыпты жағдайда жалпы қышқылдық 40-60 ммоль/л құрайды. Бос HCI 20-70 ммоль/л, байланысқан HCI 10 – 15 ммоь/л, қышқыл қалдығы 10 ммоль/л дейін.
Қалыпты және птологиялық жағдайдағы асқазан сөлінің құрам бөліктеріне сапалық реакциялар
Реактивтер: п – диметиламиноазобензолдық 0,5% - і спиртті ертіндісі, 1% фенол ертіндісі, 1%- хлорлы темірІІІ ертіндісі, 50% - ті сірке қышқылы ертіндісіндегі 0,2% - бензидин ертіндісі, 1% - сутегі қос тотығы Н2О2.
А) Асқазан сөлінің реакция ортасын анықтау.
Жұмыс жолы. 1 тамшы нативті асқазан сөлін көк түсті лакмус ертіндісіне тамызамыщ. Оның түсінің қызыл тұске ауысуы асқазан сөлінің реакция ортасының қышқылдық екенін куәландырады.
Б) бос HCI – на сапалық реакция.
Жұмыс жолы. Пробиркаға 10 тамшы асқазан сөлін құйып оған 1 тамшы 0,5% п – диметиламиноазобензол ертіндісін қосамыз. Бос HCI болғанда ертінді қызыл түске боялады.
В) сүт қышқылына сапалық реакия.
Қағида. Күлгін түсті темір фенолятының қатысуымен сүт қышқылы сары – жасыл түсті лактатқа айналады./Уфельман реакциясы/
Жұмысжолы. Пробиркаға 1 мл жуық Уфельман реакциясын құямыз /1% - ті 2 тамшы хлорлы темір күлгін түс пайда болғанға дейін/. Ертіндіге тамшылап асқазақ сөлін құямыз, егер сүт – қышқылы болса сары – жасыл түске аувсады. Соңынан қышқылды темір түзіледі.
Г) Қанға сапалық реакция
Қағида. Реакция қандағы гемоглобиннің әсерінен сутегі қос тотығының айырылуы арқылы бензидиннің от тегімен тотығуына негізделген.
Жұмыс жолы, Пробиркаға 1 мл жуық асқазан сөлін құйып оған 4 – 5 тамшы 0,2% - ті бензидин ертіндісі мен 5 тамшы 1 % сутегі пероксидін құямыз. Егер қан болса көгілдір немесе жасыл түске боялады /бензидиннің тотығу өнімі/.
Асқазан сөлінің қышқылдығының сандық мөлшерін анықтау.
Реактивтер. 0,1 н күйдігіш натрий ертіндісі , п – диметиламиноазобензол ертіндісін 0,5% спирттегі ертіндісі.
Жұмыс жолы. Алдымен сүзбеден өткізілген 5 мл асқазан сөлін колбада өлшеп аламыз, сонан 2 та