Приклади назв по міжнародній номенклатурі алкінів.
С2Н5 СН3
С1Н Ξ С2 – С3Н2 – С4Н – С5 – С6Н – С7Н2 – С8Н3 С1Н3 – С2 Ξ С3 – С4Н2 – С5Н – С6Н3
СН3 СН3 СН3
5-етил-4,5,6-триметилокт-1-ин 5-метилгекс-2-ин
Будова молекули ацетилену (етину)


V. Дієни.
| Визначення | Функціо- нальні групи | Загальна формула | Номенк- латурна назва | Види ізомерії | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
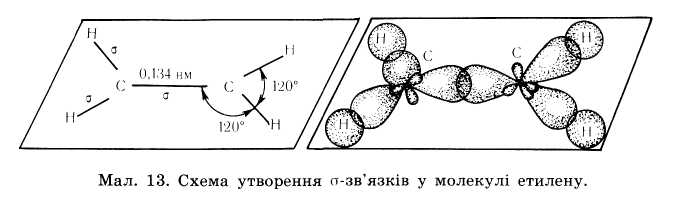
| Дієни - це ненасичені вуглеводні з двома подвійними зв’язкоми. Полімери – речовини молекули яких (макромолекули ) складаються з великої кількості груп атомів ( структурних ланок) зв’язаних між собою хімічними зв’язками. | С=С-С=С CnH2n-2 С3Н4 – пропдієн С4Н6– бутдієн С5Н8 – пентдієн С6Н10 – гексдієн С7Н12 – гептдієн С8Н14 – октдієн С9Н16 – нондієн С10Н18 - декдієн | Нумерація починається з того краю де ближче знаходиться подвійний зв'язок ,після кореня пишеться номери карбонів з яких починаються подвійні зв'язки ,в кінці пишеться закінчення дієн | 1.ізомерія карбонового ланцюга 2.ізомерія положення подвійного зв’язку 3. просторова ізомерія 4.міжкласова ізомерія з алкінами. | Два атоми Карбону, що приймають участь в утворенні подвійного зв’язку знаходяться в стані sр2– гібридизації. Тобто із чотирьох існуючих орбіта лей кожного атома вирівнюють ся лише три ( одна s, та дві р орбіта лі), і одна р – орбіталь лишається не гібридизована (має форму гантелі). Три гібридизовані орбіта лі кожного атома карбону розташовуються у вигляді двох рівносторонніх трикутників на площині.
Однією вершиною ці трикутники перекриваються утворюючи δ-зв'язок інші орбіта лі утворюють δ- зв’язки з атомами гідрогенів
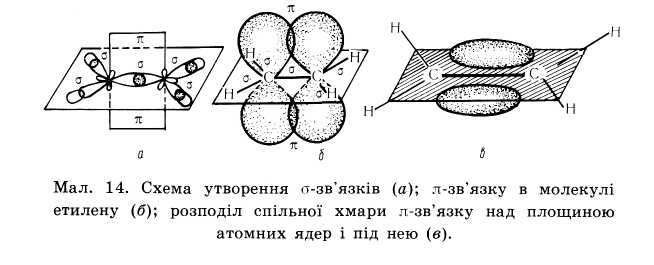
 Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків , перекриваються над і під площиною ,утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків , перекриваються над і під площиною ,утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
| 1.дієни використовують для органічного синтезу канчуків , полімерів та пластмас Найважливіші дієни: дивініл ізопрен | 1. ізопрен – природній каучук ,із соку дерева гівеї. 2. синтетичний каучук(метод Лебедева) | 1.Реакція приєднання – характерна для всіх ненасичених вуглеводнів А) приєднання водню C4H6+2H2→C4H10 Б) приєднання галогенів C4H6+2Cl2 →C4H6Cl4 В) приєднання води C4H6+H2O →C4H8(OH)2 Г) приєднання галоген оводнів правило Марковнікова: Гідроген приєднується до більш гідрогенізованого атома карбону CH2=СН-CH=CH2 +2HCl → CH3-CHCl-СНCl -CH3 2.окиснення: А) повне окиснення (горіння) 2C4H6+11O2→8CO2 +6H2O Б) часткове окиснення – знебарвлення розчину марганцівки – якісна реакція на ненасичені вуглеводні. 3. полімеризація – послідовне сполучення однакових молекул у більші за розміром (полімери) n CH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-) n → ,n – ступінь полімеризації При полімеризації дієнів утворюються каучуки. |
VІ. Каучуки.
Натуральний каучук – високоеластичний матеріал природного походження. Його добувають із латексу – молочного соку тропічної рослини – гівеї (фікус). Батьківщина гівеї – Бразилія.
Фізичні властивості: високо еластична ,тверда речовина, нерозчинна у воді, розчиняється у бензині, бензолі, сірковуглеці; водо і газонепроникні.
Натуральний каучук – природній полімер ізопрену (С5Н8) n , де n= 2500. Молекулярна маса 150000 – 500000 а.о.м.
nСН2=С – СН – СН2 → (- СН2 – С =СН – СН2 - ) n
СН3 СН3
Макромолекула лінійна , усі метильні групи знаходиться у цис-положенні, молекули не розтягнуті , а сильно вигнуті , що дозволяє сильно збільшувати довжину молекули під час розтягнення, та приймати попередню форму при знятті навантажень.
Синтетичний каучук . винайшов у 1932 році російський вчений Лебедев.
СН2=СН – СН = СН2 →( - СН2 – СН = СН – СН2 - ) n, каталізатором цієї реакції є натрій., тому цей каучук називають натрій бутадієновий каучук.
З цього каучуку виготовляють шини, взуття,ізоляційні матеріали. Він не має такої будови як натуральний каучук, тому він не такий міцний і еластичний , як натуральний.
Гума. Каучуки мають досить великий недолік у своїх властивостях : при високій температурі вони розм’якшуються , а при низькій – стають крихкими і жорсткими . якщо каучук нагріти з сіркою утворюється гума. Цей процес називають вулканізація каучуку. При цьому усуваються недоліки каучуків. S
-CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 -
S S S
( - СН2 – СН = СН – СН2 - ) n+ S→ -CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 -
S S S гума
-CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 –
S S S
Гума більш еластична, стійка до дії розчинників, та змін температур. Каучук з масовою часткою сірки до 32 % називають ебоніт. Ебоніт – тверда речовина, має властивості ізолятора.
Каучук використовують у автомобільній , авіаційній, електротехнічній промисловості, у медицині.
Хлоропреновий каучук .
nСН2=С – СН – СН2 → (- СН2 – С =СН – СН2 - ) n
СІ СІ
Цей каучук стійкий до дії світла, масел, розчинників, тому його використовують для виготовлення деталей для машин.
Інші полімери і пластмаси
Поліетилен.
nСН2=СН2 →(-СН2 – СН2 -) n
властивості: твердий , стійкий до стирання,термостійкий , розтягується при Т = 140 0С, не піддається корозійному розтріскуванню, чутливий до світла і кисню
застосування: матеріал для виробництва плівок, тари, труб, деталей технічної апаратури, предметів домашнього вжитку, іграшок, ізоляційний матеріал.
Поліпропілен.
nСН2=СНСН3 →(-СН2 – СН -) n
СН3
Використання аналогічне поліетилену.
Поліхлорвініл
nСН2=СНСІ →(-СН2 – СН -) n
СІ
Властивості: прозорий , безбарвний твердий , дуже стійкий до води, лугів, кислот, вуглеводнів, погано займається ,має здатність до само гасіння, ізолятор.
Застосування: матеріал для виробництва труб, листових і плівкових виробів, штучної шкіри, волокна, піно матеріалів, ізолятор.
Тефлон.
nСF2=СF2 →(-СF2 – СF2 -) n
властивості , твердий , білий , прозорий матеріал , робочі температури від – 200 0С до +260 0С , стійкий проти озону, хлору, плавикової кислоти, царської водки, нітратної кислоти, лугів, органічних розчинників., не займається, на отруйний, світлостійкий, діелектрик.
Застосування 6 покриття для апаратів , виготовлення спеціальних технічних виробів( ущільнювачів, шлангів, кілець, труб), виробів з низьким коефіцієнтом тертя, покриття сковорідок і каструль.
Самостійна робота студентів.
1. Назвати речовини по міжнародній номенклатурі.
С2Н5 С Br C C2H5 Cl C C C
С=С – С – С – С – С С – С Ξ С – С – С – С С – С – С С – С – С= С – С = С С Ξ С – С – С – С – С
C C C2H5 C C C
2. Написати напівструктурні формули за назвами речовин.
А) 2,5- дихлоргекс-1-ен
Б) 3,3,4 –триметил пент-1-ин
В)2,4,6- триметилокт-2, 5-дієн.
3. Серед переліку речовин виберіть алкени
С2Н4, С3С4, С2Н2, С6Н6, С7Н14, С8Н18, С10Н20
4. Напишіть формулу
А) аклану , що містить 12 атомів гідрогену
Б) алкіну , що містить 3 атома карбону
В) дієну , що містить 6 атомів гідрогену
Г) алкену , що містить 10 атомів карбону.
5. напишіть рівняння реакцій, для здійснення перетворення: С→СН4→С2Н2→С2Н4→С2Н5СІ→С4Н10→С4Н6→СО2
6. готуємось до хімічного диктанту.
Тема4 Вуглеводні
Заняття 3. Розв’язання розрахункових задач на виведення формул за відомою масовою часткою елементів сполуки.
Вид заняття: Практичне заняття 5
Мета:закріпити знання студентів по вивченим класам органічних сполук, навчитись визначати молекулярну формулу речовин по відомим масовим часткам елементів,продовжувати формувати вміння писати рівняння реакцій за поданими схемами.
Навчальні питання:
1. Назвати речовини за міжнародною номенклатурою
2. Написати напівструктурні формулу речовини за відомою номенклатурною назвою.
3. Написати напівструктурні формули ізомерів
4. Задачі на використання загальної формули органічних речовин.
5. Написати рівняння реакцій , що лежать в основі поданої схеми
6. Задачі на виведення формул за відомою масовою часткою елементів сполуки.
7. Навчальна література:
8. Л-4 с.56