Лизосомальная система и пероксисомы
Лекция № 2 Органоиды клетки
Органоиды клетки
Органоиды, или органеллы, - постоянные специфические структуры цитоплазмы, выполняющие определенные функции, необходимые для поддержания жизнедеятельности клетки.
Различают органоиды общего значения и специальные органоиды. Органоиды общего значения имеются во всех клетках и выполняют функции, общие для всех клеток – митохондрии, рибосомы, эндоплазматическая сеть, комплекс Гольджи, лизосомы, пероксисомы, цитоскелет и клеточный центр.
Органоиды специального значения имеются только в клетках какого-то определенного типа и обеспечивают выполнение функций, присущих только этим клеткам.
Мембранные органоиды:
- ядро;
- эндоплазматическая сеть;
- аппарат Гольджи;
- митохондии;
- лизосомы;
- пероксисомы;
- вакуоли.
Немембранные органоиды
- рибосомы;
- клеточный центр;
- цитоскелет.
Эндоплазматическая сеть открыта Портером в 1945 году. Морфология – сеть канальцев и цистерн сложенных мембранами. Различают гранулярную (шероховатую, зернистую) и гладкую ЭПС.
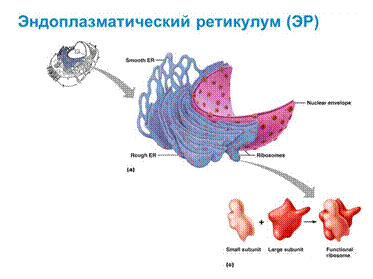
Гранулярная ЭПС содержит рибосомы на наружной стороне мембраны, обращенную к гиалоплазме. Гладкая ЭПС не содержит рибосомы. В скелетных мышцах ЭПС носит название саркоплазматический ретикулум. ЭПС пронизывает всю клетку. Полость ЭПС сообщается с перинуклеарным пространством ядра, а мембрана ЭПС с плазматической мембраной ядра. На рибосомах гранулярной ЭПС синтезируются секреторные белки, предназначенные для выведения из клетки, а также белки лизосом и внеклеточного матрикса.
Синтез указанных белков включает 5 этапов:
1. Связывание сигналраспознающtй частицы (SRP), состоящий из 6-ти белков и малой цитоплазматической РНК (srpРНК) с сигнальной последовательность полипептидной цепи.
2. Взаимодействие комплекса матричной РНК (мРНК) – рибосома - SRP со специфическим белком-рецептором (SRP-рецептором), находящимся на цитоплазматической стороне мембраны.
3. Освобождение SRP от комплекса; связывание рибосомы с белок-транслоцирующим комплексом мембраны шероховатой ЭПС транслоконом и встраивание сигнальной последовательности в канал транслокона.
4. Возобновление трансляции и перенос растущей полипептидной цепи в полость ЭПС.
5. Удаление сигнальной последовательности от полипептида под действием фермента.
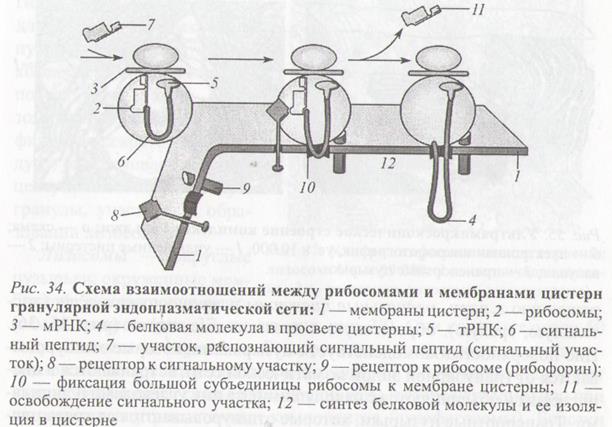
В полости ЭПС синтезированные водорастворимые белки подвергаются фолдингу и гликозилированию путём присоединения к белкам однотипных олигосахаридных цепочек. В результате фолдинга белки приобретают специфическую конформацию, и в составе транспортных пузырьков, отделяющихся от мембраны ЭПС, транспортируются в комплекс Гольджи, где подвергаются дальнейшим модификациям и сортировке.
Наряду с секреторными белками на гранулярной ЭПС синтезируется большая часть полуинтегральных и интегральных белков. В ЭПС происходит также синтез мембраны липидов и осуществляется «сборка» компонентов мембраны.
Кроме того, ЭПС, как считают, участвуют в образовании пероксисом. Таким образом, грЭПС служит «фабрикой» мембран для плазмалеммы, аппарата Гольджи, лизосом и других мембранных структур клетки. ЭПС обеспечивает также сегрегацию (разделение) белков, предназначенных на экспорт, и лизосомных гидролаз от литозольных белков.
Агранулярная (гладкая) эндоплазматическая сеть представляет собой замкнутую сеть трубочек, канальцев, цистерн и везикулярных образований размером 50 —100 нм и образуется, по-видимому, из гранулярной ЭПС.
На цитоплазматической поверхности гладкой ЭПС синтезируются жирные кислоты, холестерол и большая часть липидов клетки, в том числе почти все липиды, необходимые для построения клеточных мембран. Поэтому гладкую ЭПС нередко называют «фабрикой липидов». В клетках печени (гепатоцитах) с мембранами гладкого эндоплазматического ретикулума связан фермент, обеспечивающий образование глюкозы из глюкозо-6-фосфата. Эта реакция имеет большое значение в поддержании уровня глюкозы в организме человека. Кроме того, гладкая эндоплазматическая сеть осуществляет детоксикацию (обезвреживание). Большую роль в процессах детоксикации играют ферменты семейства цитохрома Р450.
Помимо указанных основных функций, гладкая эндоплазматическая сеть выполняет ряд дополнительных. В ее мембранах локализуются Са2+ - насосы, активно закачивающие ионы Са2+ из цитозоля в полость саркоплазматической сети. Поэтому концентрация ионов Са2+ в полости гладкой эндоплазматической сети достигает 10-3 моль/л, т.е. почти в 10 000 раз выше, чем в цитозоле. Под действием химических сигналов ионы Са2+ переносятся из полости гладкой ЭПС через ионные каналы, встроенные в ее мембрану, в гиалоплазму, где связываются с определенными белками, влияющими на множество внутриклеточных процессов: активацию или инактивацию ферментов, экспрессию генов, освобождение антител из клеток иммунной системы и др.
В мышечных волокнах гладкая ЭПС имеет структурные и функциональные особенности и называется саркоплазматической сетью. При возбуждении плазмалеммы выход ионов Са2 из гладкой эндоплазматической сети в цитозоль стимулирует сокращение миофибрилл.
В организме человека эндоплазматическая сеть особенно хорошо развита в клетках, синтезирующих гормоны, в клетках печени (гепатоцитах) и некоторых клетках почек.
Комплекс Гольджи (КГ), или аппарат Гольджи, - пластинчатый комплекс, расположен вблизи ядра, между ЭПС и плазмалеммой. Его структурнофункциональная единица — диктиосома представляет собой стопку из 5—20 плоских одномембранных мешочков (цистерн), имеющих диаметр около 1 мкм, внутренние полости которых не сообщаются друг с другом. Количество таких мешочков в стопке обычно не превышает 5-10, а расстояние между ними составляет 20—25 нм.
В каждой диктиосоме различают три части, проксималъную (cis-полюс), обращенную к ЭПС, медиальную и дистальную (trans- полюс), обращенную к плазмалемме. К дистальной цистерне транс-полюса примыкают многочисленные трубочки и пузырьки, образующие транс-сеть аппарата Гольджи.

Белки, синтезированные на шероховатой эндоплазматической сети в составе отпочковывающихся от нее мембранных пузырьков, покрытых клатрином, транспортируются к цис-полюсу аппарата Гольджи. В аппарате Гольджи осуществляется химическая модификация транспортируемых белков. Этот процесс происходит поэтапно по мере транспорта белков от цис- к транс-полюсу аппарата Гольджи, каждая цистерна которого содержит характерный для нее набор ферментов.
В транс-сети осуществляется сортировка белков и упаковка их в мембранные пузырьки, покрытые клатрином. Белки, предназначенные для экспорта, заключаются в одни пузырьки, лизосомные белки — в другие, мембранные белки — в третьи. В специальные пузырьки упаковываются также белки, присущие ЭПС, например ферменты фолдинга, которые случайно оказались в комплексе Гольджи.
Сортировка белков осуществляется при помощи встроенных в мембрану транс-сети КГ особых белков-рецепторов, способных специфически взаимодействовать с определенными химическими группировками — маркерами молекул отбираемых белков. В результате участок мембраны, несущей рецепторы, связанные с маркерами отбираемых молекул, обособляется от КГ с образованием мембранного пузырька, покрытого клатрином, транспортирующего нужное вещество к месту назначения. Например, маркером лизосомальных ферментов служит присоединяющийся к ним в комплексе Гольджи олигосахарид, содержащий остаток маннозо-6-фосфата. Для белков ЭПС — ферментов фолдинга и др., которые случайно оказались в КГ, таким маркером служит последовательность из четырех аминокислот, по которой они узнаются и упаковываются в пузырьки, а затем возвращаются обратно в ЭПС. Этот процесс получил название рециклизации.
Секреция экспортных белков осуществляется посредством конститутивной и регулируемой секреции.
В случае конститутивной секреции посредством конститутивной секреции осуществляется также транспорт мембранных белков плазмалеммы.
Регулируемая секреция свойственна лишь специализированным клеткам, секретирующим биологически активные вещества в ответ на действие сигналов, например гормонов.
Таким образом, основными функциями комплекса Гольджи являются химическая модификация, накопление, сортировка, упаковка в секреторные пузырьки и транспорт по назначению белков и липидов, синтезированных в эндоплазматическом ретикулуме. В комплексе Гольджи образуются лизосомы и синтезируются некоторые полисахариды.
Лизосомальная система и пероксисомы
Лизосомы – мембранные органеллы клеток животных и грибов, содержащие
гидролитические ферменты и осуществляющие гидролитическое расщепление макромолекул (внутриклеточное пищеварение). Лизосомы представляют собой окруженные одинарной мембраной пузырьки, размеры которых в клетках животных колеблются от 0,2 до 0,5 мкм. В лизосомах содержится не менее 60 гидролитических ферментов: протеаз, гликозидаз, липаз, нуклеаз и др., которые расщепляют все основные классы органических макромолекул. Все ферменты лизосом активны лишь в кислой среде при значениях pH, близких 5,0. Такие значения pH достигаются благодаря наличию в мембране этих органелл протонных насосов. Количество лизосом в разных клетках варьирует от единичных до нескольких сотен, как например, в фагоцитах и остеокластах.
Согласно современным представлениям, формирование лизосом тесно связано с процессами эндоцитоза и может происходить разными путями.

Мембранные пузырьки, образующиеся в процессе пиноцитоза, теряют клатриновую оболочку и, сливаясь между собой, формируют ранние эндосомы, которые располагаются неподалеку от плазмалеммы в периферических отделах цитоплазмы. В случае эндоцитоза, опосредованного рецепторами, в ранних эндосомах в условиях слабокислой среды (pH 6,0) происходит отщепление лигандов от рецепторов после чего рецепторы в составе транспортных пузырьков, отделяющихся от ранней эндосомы, доставляются в плазмалемму. Этот процесс получил название рециклирования рецепторов (от англ. recycling - возвращение). В связи с этим раннюю эндосому называют также компартментом для разделения рецепторов и лигандов.
Дальнейшее ферментативное расщепление макромолекул, поступивших в процессе пиноцитоза в ранние эндосомы, осуществляется в поздних эндосомах, расположенных в перинуклеарной области и имеющих, по сравнению с ранними эндосомами, более крупные размеры (диаметр 600—800 нм) и более кислое внутреннее содержимое (pH 5,5). Формирование поздних эндосом связано со слиянием их мембран с мембранами многочисленных гидролазных пузырьков, отшнуровывающихся от аппарата Гольджи (первичные лизосомы по старой терминологии). Кислая среда поздних эндосом способствует освобождению гидролаз от рецепторов, после чего рецепторы в составе пузырьков, отшнуровывающихся от поздних эндосом, рециклируют в комплекс Гольджи.
Завершающие этапы процесса внутриклеточного переваривания веществ, поглощенных клеткой, осуществляются в лизосомах, ранее называвшихся вторичными лизосомами, кислая внутренняя среда которых (pH 5,0 и ниже) обеспечивает максимальную ферментативную активность лизосомных гидролаз и наиболее глубокое расщепление макромолекул.
При фагоцитозе — поглощении клеткой бактерий, фрагментов клеток и других крупных корпускулярных частиц — вначале образуются фагосомы, называемые также гетерофагосомами. Затем мембраны таких фагосом сливаются с мембранами поздних эндосом или лизосом с формированием фаголизосом, которые и осуществляют процессы ферментативного расщепления субстратов, поглощенных клеткой.
Процесс переваривания лизосомами внеклеточных веществ, захваченных путем эндоцитоза, называется гетерофагией и служит основным способом пищеварения у большинства одноклеточных организмов. У многоклеточных животных гетерофагия присуща всем клеткам. В то же время фагоцитоз и формирование фаголизосом свойственен лишь некоторым специализированным клеткам-лейкоцитам, тканевым макрофагам и другим клеткам, способным поглощать и переваривать микроорганизмы и другие чужеродные для организма корпускулярные структуры. Помимо гетерофагии, в лизосомах протекают процессы аутофагии.
Аутофагия клеточных структур, выработавших свой ресурс, осуществляется в аутофаголизосомах, образующихся при слиянии поздних эндосом или лизосом с аутофагосомами — мембранными пузырьками, несущими структуры клетки, подлежащие разрушению, например митохондрии. Источником мембраны аутофагосомы, окружающей перевариваемые клеточные компоненты, как предполагают, служит грЭПС.


Посредством аутофагии расщепляются также собственные белки клетки. Этот процесс может осуществляться неспецифическим путем, когда белки окружаются мембраной и доставляются в поздние эндосомы или лизосомы. Таким образом, например, разрушаются белки при голодании и дефиците энергетических ресурсов организма. Возможно также избирательное разрушение белков в лизосомах. В этом случае белки транспортируются из гиалоплазмы в лизосомы непосредственно через мембраны лизосом с участием белков-шаперонов. Биологическое значение аутофагии исключительно велико. Например, в клетках печени человека в результате аутофагии в течение недели заменяется половина содержащихся в них молекул белков.
Лизосомы с помощью своих ферментов могут разрушать не только отдельные органеллы или клетки, но и целые органы (автолиз). Например, и процессе онтогенеза лягушки с помощью ферментов лизосом лизируются хвост и жабры головастика, а образующиеся при этом продукты распада используются для формирования органов взрослого животного.
В случае неполного переваривания веществ, содержащихся, в лизосомах, лизосомы превращаются в телолизосомы или остаточные тельца. Их накопление в клетке указывает на ее старение.
Пероксисомы по своему строению сходны с лизосомами, однако отличаютсяот них по выполняемым функциями способу образования. Пероксисомыпредставляют собой мембранные сферические или удлиненные пузырьки диаметром 0,05—1,5 мкм, во внутреннем содержимом (матриксе) которых с помощью электронного микроскопа выявляется более плотная сердцевина (нуклеоид), имеющая кристаллическое строение и состоящая из фибрилл и трубочек.
Количество пероксисом в клетках разного того типа широко, варьирует. Особенно многочисленны они в клетках печени человека, где пероксисомы обновляются каждые 5—6 дней.
Матрикс пероксисом содержит около 50 ферментов, состав которых в клетках разного типа значительно отличается. Наибольшее значение из указанных ферментов имеют оксидазы аминокислот и других органических соединений, пероксидаза, каталаза и некоторые ферменты синтеза плазмогенов. Пероксисомы получили свое название благодаря тому, что входящие в состав их оксидазы используют молекулярный кислород для отщепления атомов водорода от некоторых органических субстратов (R) с образованием перекиси водорода (Н202). По этой причине пероксисомы, наряду с митохондриями, являются главными потребителями 02 в клетке. В общем виде реакция протекает следующим образом:

Пероксид, выделяющийся в ходе указанной реакции, каталаза использует для окисления органических веществ, токсичных для организма человека, например фенолов, муравьиной кислоты, формальдегида, этилового спирта и др. Реакция протекает по схеме:

В пероксисомах разрушается также пероксид, образующийся в митохондриях и других компартментах клетки, где протекают окислительные реакции. Таким образом, нейтрализация переоксида является одной из важнейших функций пероксисом.
Наряду с разрушением пероксида в пероксисомах синтезируются желчные кислоты, холестерин, протекают реакции начального этапа синтеза плазмогенов — липидов, участвующих в формировании миелиновой оболочки нервных волокон.
Образование пероксисом происходит в ЭПС путем отпочковывания этих органелл от элементов гладкой эндоплазматической сети. Большая часть ферментов пероксисом синтезируется в цитозоле на свободных рибосомах. Адресная доставка таких белков к пероксисомам достигается благодаря наличию в их структуре специальных сигнальных последовательностей, которые распознаются белками пероксинами, встроенными в мембрану пероксисом. Пероксисомы образуются путем почкования.