Влияние различных условий на скорость окислительно-восстановительных реакций
На скорость реакций окисления-восстановления влияют следующие факторы:
1. Концентрация. Скорость редокс-реакций тем больше, чем больше концентрация реагирующих веществ (до определенных пределов).
аОк1 + b Восст1→ с Восст2 + d Ок2
2. Температура. Повышение температуры эндотермических реакций на каждые 10 градусов увеличивает скорость реакции в 2–3 раза (правило Вант-Гоффа).
3. рН раствора. Концентрация Н+– или ОН-–ионов изменяет скорость реакций, идущих с их участием.
4. Присутствие катализатора или ингибитора. Катализатором может быть постороннее вещество или продукт реакции (автокаталитические реакции). Например, взаимодействие перманганата калия с оксалатом натрия начинает протекать через значительный промежуток времени, несмотря на большую разность потенциалов.
1.3 Характеристика методовредоксиметрии
Название методов редоксиметрии обычно происходит от названия используемых титрованных растворов рабочих веществ (РВ). В настоящее время разработано более 50-ти методов окислительно-восстановительного титрования.
Наиболее широкое применение получили следующие виды редокс-титрования, представленные в табл. 1.
Перманганатометрия
В перманганатометрическом титровании в качестве рабочего вещества используют перманганат калия. Растворы его готовят, как правило, по приблизительной навеске, затем выдерживают 7–10 дней, отфильтровывают выделившийся MnO2 и устанавливают точную концентрацию титрованием. Титруют без индикатора: в конечной точке титрования от малейшего избытка KMnO4 раствор окрашивается в бледн-розовый цвет. Раствор KMnO4 можно готовить из фиксанала, используя бидистиллированную воду.
В качестве установочных веществ используют щавелевую кислоту Н2С2О4 · 2Н2О и ее соли Na2C2O4, (NH4)2C2O4 и другие. Во-первых, титрование чаще всего ведут в кислой среде, так как окислительная способность перманганата калия в кислой среде выше, чем в щелочной. Во-вторых, легче фиксировать точку эквивалентности (из бесцветного раствора переходит в бледно-розовый). В нейтральной же и слабощелочной средах образуется бурый осадок MnO2 и на его фоне труднее фиксировать точку эквивалентности. В-третьих, ионы Mn2+ играют роль катализатора в данной реакции и увеличивают скорость ее протекания. Для подкисления титруемых растворов чаще всего применяют серную кислоту, так как азотная кислота, являясь окислителем, может способствовать возникновению нежелательных побочных процессов, а соляная кислота может окисляться перманганатом калия или промежуточными оксидами, которые образуются в ходе основной реакции.
Таблица1─ Классификация методов редоксиметрии
| Название метода (титрант) | Стандартные вещества | Эквивалент |
| Перманганатометрия (KMnO4) | H2C2O4 × 2H2O Na2C2O4 | 1/5 KMnO4 1/2 Na2C2O4 |
| Иодометрия (Na2S2O3) | J2 K2Cr2O7 KBrO3 | Na2S2O3 1/2 J2 1/6 K2Cr2O7 |
| Иодиметрия (J2) | As2O3 | 1/6 As2O3 |
| Дихроматометрия (K2Cr2O7) | − | 1/6 K2Cr2O7 |
| Бромато- метрия (KBrO3) | − | 1/6 KBrO3 |
Точку эквивалентности в перманганатометрии определяют безиндикаторным методом, но в случае титрования очень разбавленными растворами перманганата калия применяют редокс-индикаторы: чаще дифениламин, ферроин. По методу перманганатометрии можно количественно определять окислители, восстановители и вещества, способные взаимодействовать с окислителем или восстановителем.
Перманганатометрию применяют и для анализа легко окисляющихся органических соединений (альдегидов, кетонов, спиртов, карбоновых кислот: щавелевой, винной, лимонной, яблочной, а также гидразогрупп). В пищевой промышленности перманганатометрию можно исползовать для определения содержания сахара в пищевых продуктах и сырье, окисляемости воды, содержания нитритов в колбасных изделиях.
Иодометрия и иодиметрия
В основе данных методов используется реакция:
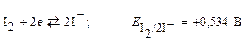 .
.
Восстановители, имеющие редокс-потенциал меньше +0,534 В, способны окисляться свободным иодом. Ионы I– способны восстанавливать окислители, имеющие редокс–потенциал больше +0,534 В. Восстановители определяют прямым или обратным (слабые восстановители) титрованием раствором иода. Слабые восстановители можно определять и прямым титрованием, но для этого предварительно необходимо понизить потенциал их систем введением в раствор соответствующих комплексообразователей.
Для определения окислителей используют рабочий раствор Na2S2O3 и способ замещения.
K2Cr2O7 + 7H2SO4 + 6KI → K2SO4 + Cr2(SO4)3 + 3I2 + 7H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Окислитель вытесняет из KI эквивалентное количество заместителя I2, который затем оттитровывают рабочим раствором тиосульфата натрия Na2S2O3. Метод титрования раствором I2 называют иодиметрией, заместительное титрование – иодометрией. Прямая реакция восстановления иода идет быстро, но обратная реакция окисления иодид–ионов протекает медленно.
I– – слабый восстановитель, поэтому перед титрованием анализируемую пробу с добавленным к ней КI выдерживают 5 минут в темноте. В кислой среде КI переходит в НI, и на свету НI разлагается до I2, что вызывает повышенный расход раствора титранта. Обычно используют избыток KI, который необходим для лучшего растворения выделившегося I2, предупреждения его улетучивания и увеличения скорости реакции. Растворы Na2S2O3 готовят по приблизительной навеске с добавлением Na2СO3, выдерживают 7–10 дней, отфильтровывают выделившуюся серу и устанавливают точную концентрацию титрова-
нием. Карбонат натрия добавляют для стабилизации тиосульфата, который легко взаимодействует с кислородом воздуха и диоксидом углерода. В качестве установочного вещества для Na2S2O3 используют дихромат калия, раствор которого готовят из фиксанала или по точной навеске. Необходимо строгое соблюдение рН и температуры раствора.
В качестве индикатора используют специфический индикатор – крахмал, который с раствором йода образует характерную синюю окраску, связанную с образованием адсорбированного комплекса.
Растворы I2 в иодометрии готовят по точной или приблизительной навеске или из фиксанала. Иод легко очищается от примесей сублимацией. Следует учитывать, что иод летуч и взвешивание его надо проводить в бюксах (стеклянные стаканчики с пришлифованной пробкой). Ввиду малой растворимости йода, растворы его готовят с добавлением KI. При этом образуются растворимые в воде комплексы [I3]- или [I5]-, например:
I- + I2→ [I3]-.
Если необходимо, точную концетрацию раствора йода устанавливают с помощью титрованного раствора стандартного вещества оксида мышьяка As3O3 или тиосульфата натрия Na2S2O3.
В пищевой промышленности методом иодометрии определяют витамин С в овощах и фруктах, остаточный хлор в хозяйственно-питьевой воде после ее хлорирования, медь в кондитерских изделиях, сернистую кислоту в производстве сырого кукурузного крахмала, содержание хлеба в котлетном фарше, олова в консервах.
Дихроматометрия
В методе дихроматометрии в качестве рабочего вещества используют дихромат калия (K2Cr2O7).
K2Cr2O7 – вещество стандартное и растворы его готовят по точной навеске или из фиксанала. Для фиксирования точки эквивалентности используют редокс-индикаторы – дифениламин, дифениламиносульфокислоту, дифенилантраниловую кислоту. Прямым титрованием определяют восстановители.
Броматоматрия
В броматометрии в качестве рабочего вещества используют бромат калия KBrO3. Окислительно-восстановительный потенциал редокс -пары Е0 (BrO3–+ +6Н+/ Br –+3Н2О) равен 1,44 В. Несмотря на высокое значение стандартного редокс–потенциала скорость реакции окисления броматом недостаточно высока, и титрование ведут в сильно кислой среде при нагревании.
Раствор KBrO3 может быть приготовлен по точной навеске соли, перекристаллизованной и высушенной при температуре 150–180 °С. Если же раствор готовят по приблизительной навеске, то концентрацию устанавливают йодометрически: добавляют КI и НCl и выделившийся в эквивалентном количестве йод титруют в присутствии крахмала раствором тиосульфата натрия до обесцвечивания раствора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Лабораторная работа № 1 «Определение ионов железа (II) в соли Мора перманганатометрическим методом (6 часов)
Цель работы: освоить основные операции окислительно-восстановительного метода титрования и определить содержание ионов железа ( II ) в растворе его соли.