Диаграмма состояния сплавов системы свинец – сурьма
Теория сплавов
Сплав – вещество, состоящее из двух и более элементов.
Система – совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление).
Фаза – однородная по химическому составу и внутреннему строению часть системы.
Компоненты – вещества образующие систему.
В большинстве случаев входящие в сплав элементы в жидком состоянии полностью растворимы друг в друге, т.е. представляют собой жидкий раствор. В процессе кристаллизации сплава могут образовываться следующие типы сплавов: твердые растворы, химические соединения и механические смеси.
Основное отличие кристаллизации сплавов от кристаллизации чистых металлов состоит в том, что сплавы кристаллизуются не при одной строго определенной температуре, а в интервале температур, т.е. от температуры начала кристаллизации до температуры конца кристаллизации (кроме эвтектики).
Таким образом, металлы при кристаллизации имеют одну критическую точку, а сплавы две (кроме эвтектики).
Эвтектика – сплав, который является механической смесью двух структур, выделяющихся одновременно при постоянной температуре (самой низкой для данной системы) и определенной концентрации сплава.
Диаграммы состояния двойных сплавов
Правило фаз или закон Гиббса. Состояние сплава зависит от внешних условий (температуры, давления) и характеризуется числом и химическим составом образовавшихся фаз. Возможность изменения внешних условий без изменения числа фаз, находящихся в равновесии, называется вариантностью или числом степеней свободы системы. Правило фаз определяет взаимосвязь между числом степеней свободы, числом компонентов и числом фаз, находящихся в равновесии:
С = К + 2 – Ф ,
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз, находящихся в равновесии;
2 – число внешних факторов (температура, давление).
В металлических сплавах давление мало влияет на фазовое равновесие, поэтому уравнение принимает следующий вид:
С = К + 1 – Ф ,
Если двухкомпонентная система находится в расплавленном состоянии (К=2, Ф=1), то имеем две степени свободы (С=2), т.е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы.
Для той же системы при наличии двух фаз (жидкой и твердой) имеем К=2, Ф=2 и С=1, т.е. систему моновариантную (одновариантную). С изменением температуры концентрация должна быть строго определенной.
Для той же системы при наличии трех фаз имеем К=2, Ф=3 и С=0, т.е. систему нонвариантную (безвариантную). Сплав из данного числа фаз может существовать только при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
Диаграмма состояния сплавов системы свинец – сурьма
Рассмотрим построение диаграммы системы «Pb – Sb» (рисунок 1). К системе сплавов свинец сурьма относятся все сплавы между чистым свинцом и чистой сурьмой.
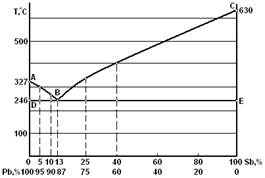
Рисунок 1 – Диаграмма состояния сплавов системы «Pb – Sb»
Кривые охлаждения компонентов и сплавов представлены на рисунке 2.
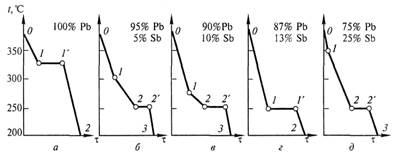
Рисунок 2 – Кривые охлаждения сплавов системы «Pb—Sb»
Линия ABC – линия ликвидуса (ликвидус – от лат. «жидкий»). Ниже линии DBE все сплавы системы находятся в твердом состоянии. Линия DBE – линия солидуса (солидус – от лат. «твердый»).
В точке В при массовом содержании 13 % Sb, 87 % Pb и при температуре 246 °С кристаллизация свинца и сурьмы происходит одновременно; образуется тонкая механическая смесь кристаллов свинца и сурьмы (двух фаз). Эта смесь называется эвтектикой.
Правило отрезков. Впроцессе кристаллизации изменяется химический состав фаз и их масса (масса жидкости уменьшается, а твердой фазы — увеличивается, при этом, естественно, суммарная масса фаз остается постоянной, равной массе сплава).
Правило отрезков служит для определения химического состава фаз (т.е. содержания в них компонентов) и массового соотношения фаз в любой точке двухфазных областей диаграммы. Для их определения через точку, характеризующую положение сплава на диаграмме, проводят горизонтальную линию (коноду)до пересечения с линиями диаграммы, ограничивающими двухфазную область, в которой лежит заданная точка. Проекция точки пересечения коноды и линии диаграммы состояния на ось концентраций показывает состав той фазы, с которой граничит точка пересечения. Так, т. а' определяет концентрацию компонентов в жидкой фазе, а т. с' — концентрацию компонентов в твердой фазе (рисунок 3).

Рисунок 3 – Структурная диаграмма сплавов системы «Pb – Sb»
Для определения количественного соотношения фаз пользуются правилом рычага. Все количество сплава соответствует отрезку ас. Количество соответствующей фазы определяется противолежащим отрезком: количество жидкости — отрезком bс, а твердой фазы — отрезком ab.