Значение белка в питании для сохранения мышечной массы и функции
Протеин, потребляемый из пищи, необходим для сохранения мышечной массы и функции, а также — из-за тесной связи — для прочности костной системы. Текущие рекомендации (RDA) для белка, учитывая нужды всего организма, составляют 0.8 грамм/(кг/день) (0.32/кг/СМТ/день, если полагать сухой массой тела (СМТ) 40% от всего веса — Janssen et al. 2000). Однако RDA не учитывает возможную разницу в потребности для поддержания здоровой мускулатуры у молодых и пожилых людей. Поскольку накоплено немало подтверждений, что превышение рекомендаций RDA по белку приносит различные полезные эффекты (Morley et al. 2010), следует определить оптимальный объем протеина в питании для развития (или хотя бы сохранения) мышечной/костной системы в пожилом возрасте.
Достаточное количество белка в рационе стимулирует синтез мышечных протеинов, поставляя незаменимые аминокислоты (Chesley et al. 1992; Tipton et al. 1999). В частности лейцин, аминокислота с разветвленной цепью, может оказывать анаболическое воздействие, стимулируя синтез белка и связанные с mTOR сигналы при отсутствии других незаменимых аминокислот (и в большей степени, чем они) (Atherton et al. 2010; Wilkinson et al. 2013). Анаболический отклик мышц на поступление аминокислот продолжается недолго, доходя до пика через ~2 часа после поглощения протеина и опускаясь через ~3 часа (Burd et al. 2010; Mitchell et al. 2015), даже если уровень аминокислот остается повышенным (Bohé et al. 2001).
Некоторые исследования показали, что этот отклик на прием белка у пожилых людей значительно ниже (Cuthbertson et al. 2005; Guillet et al.2004; Katsanos et al. 2005; Volpi et al.2000). Но надо отметить, что не все эксперименты зафиксировали анаболическую резистентность, связанную с возрастом (Paddon-Jones et al. 2004; Pennings et al. 2011); возможно, из-за различия в методах оценки уровня синтеза мышечного протеина (Burd et al. 2012). Старение ассоциируется с большей висцеральной экстракцией аминокислот [отбор белка внутренними органами для своих нужд — прим. пер.], таким образом снижая объем получаемого из пищи протеина (Volpi et al. 1999). Также у пожилых людей наблюдается нарушение микрососудистой перфузии [питание тканей через их сосудистую систему — прим. пер.] (Mitchell et al. 2013), что осложняет доставку незаменимых аминокислот в мышцы.
Мур с коллегами (2015) провели ретроспективный анализ исследований для сравнения уровня синтеза мышечных белков у молодых и пожилых людей после приема различных доз высококачественного протеина. Минимальный объем протеина, приводящий к наибольшему отклику, составил 0.25 г/кг/СМТ (сухой массы тела) у молодых людей и 0.61 г/кг/СМТ у пожилых; таким образом, с возрастом организм слабее реагирует на пищевой белок и требует большее количество, чем в юности (Рис. 3). При этом надо учесть, что многие пожилые люди не набирают и рекомендуемые RDA нормы белка по самым разным причинам, от снижения аппетита и ухудшения пищеварения до социо-экономических факторов. Одной из главных проблем является нездоровый режим питания (Tieland et al.2012). Например, протеин в утреннем и дневном приемах пищи обычно не приводит к такой же максимальной стимуляции синтеза мышечного белка, которая вызывается протеиновым ужином (Tieland et al. 2012).
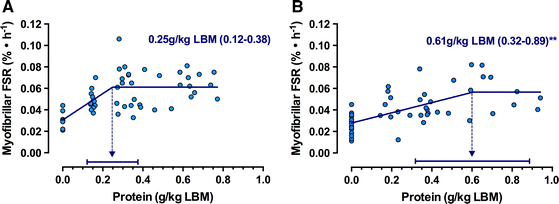
Рисунок 3
Старение связано с пониженным анаболическим откликом на прием белковой пищи. Сравнительный анализ показывает, что доза протеина, необходимая для максимальной стимуляции синтеза миофибриллярной фракции, у молодых людей (a) на 40% ниже, чем у пожилых (b). На основе данных (Moore et al. 2015)
Согласно данным Мура и коллег (Moore et al. (2015)), семидесятилетний человек весом 80 кг (имеющий СМТ около 30% от общей массы (т.е. 24 кг) и питающийся три раза в день (Short and Nair 2000)) должен получать ~147 граммов белка в сутки или ~1.8 г/кг, что превышает рекомендуемую норму RDA более чем в два раза. В поддержку этого предположения можно привести работу Кима с коллегами ((Kim et al. (2015)), которая показала, что потребление 1.5 г/(кг/массы тела) белка (почти в два раза больше текущей нормы RDA—0.8 г/(кг/массы тела)] привело к значительно большей стимуляции синтеза мышечного белка в течение суток по сравнению с рекомендуемым приемом на уровне 0.8 г/(кг/массы). В этом исследовании не было зафиксировано дополнительного анаболического эффекта при сравнении равномерного и неравномерного распределения протеина в приемах пищи (Kim et al. 2015). Помимо кратковременного повышения уровня синтеза белка есть и долгосрочные эффекты, например, Кэмпбелл с коллегами (Campbell et al. (2001)) обнаружил, что у пожилых людей, потреблявших рекомендуемую RDA дозу белка в течение 14 недель, значительно снизилась мышечная масса бедер. Другое исследование показало, что пожилые люди, у которых в рационе белок составлял ~19% от общего калоража, потеряли на ~40% меньше мышц, чем люди с ~11% белка от общего калоража (Anderson et al. 2011).
При том, что многие пожилые и так не набирают достаточное количество белка для поддержания здоровья, ситуация ухудшается в период заболевания (Covinsky et al. 1999). Неполноценное питание во время острых приступов и при хронических проявлениях болезни затягивает выздоровление и повышает риск развития осложнения, приводя к повторной госпитализации (Covinsky et al. 1999). Ограничение подвижности, связанное с постельным режимом, чаще вызывыает негативные последствия у пожилых людей, например, всего неделя в постели вызывает атрофию мышц и анаболическую резистентность (Drummond et al. 2012). Подобные ухудшения фиксировались у пожилых после 14 дней частично ограниченной подвижности (Breen et al. 2013). Все больше специалистов сходится во мнении, что увеличение потребления белка (выше рекомендуемых RDA доз) в период заболевания и госпитализации ускоряет выздоровление и помогает сохранить скелетную мускулатуру (Cawood et al. 2012). Потери мышц из-за неподвижности были зафиксированы даже при потреблении белка на уровне 1.0–1.2 г/(кг/массы тела) (Trappe et al. 2007). Клиническое исследование обнаружило, что самые тяжелобольные из возрастных пациентов потребляли меньше всего белка (Pichard et al. 2004). Помимо улучшения состояния мышц было выявлено, что при превышении норм RDA растет и минеральная плотность костной ткани (Devine et al. 2005; Meng et al.2009). При переломе шейки бедра увеличение количества белка (более текущих рекомендаций RDA) в пище или в добавках ассоциируется с повышением плотности костей и сокращением времени восстановления (Schurch et al. 1998). Мнение, что увеличение потребления белка приводит к повышению кислотности крови и резорбции [растворению — прим.пер.] кальция из костей, опровергается несколькими мета-анализами (Fenton et al.2008; Fenton et al. 2010; Fenton et al. 2009a; Fenton et al. 2009b). Подводя итог, сегодня очевидна необходимость повышения рекомендуемых норм приема белка пожилым людям для поддержания скелетной мускулатуры и качества жизни; специалисты советуют увеличить дозу до 1.0-1.2 г/(кг массы тела) (Bauer et al. 2013). При заболеваниях и ограничениях подвижности, например, постельном режиме, норму рекомендует GJdподнимать до 1.2-2.0 г/(кг/массы тела), в зависимости от тяжести заболевания и неполноценности рациона (Bauer et al. 2013).
Повышать продолжительность жизни или качество?
Вышеупомянутые исследования ясно показывают, что размер и сила скелетной мускулатуры имеют критическое значение для сохранения здоровья в старости, а уровень синтеза мышечного белка в большой степени зависит от тренировок и потребления протеина. Однако изучение старения на животных выявило, что подавление белкового синтеза (ингибирование mTORC1, ограничение калоража) увеличивает продолжительность жизни (Kapahi et al. 2010).
Например, рапамицин, ограничивающий действие mTORC1, увеличивает срок жизни многих организмов, включая дрожжевые грибки (Kaeberlein et al. 2005), круглых червей (Jia et al. 2004) и дрозофил (Kapahi et al. 2004). В исследованиях на мышах при смертности 90% рапамицин увеличивал мышей продолжительность жизни на 14% у самцов и на 9% у самок, повышая выживаемость как при позднем применении (возраст 600 дней), так и в середине срока (270 дней) (Harrison et al. 2009). Отключение отдельных регуляторов eIF4G и S6K1 (Selman et al. 2009) повышало срок жизни у изучаемых организмов, а у особей с мутациями, приводившими к понижению уровня инсулина и инсулиноподобного фактора роста (IGF1) (ключевые факторы, управляющие активностью mTORC1 и синтезом белка во время развития), реже развивались рак и диабет (Guevara-Aguirre et al. 2011; Shevah and Laron 2007). Дополнительно отмечено, что у потомков долгожителей (со сниженным риском развития определенных заболеваний и увеличенной продолжительностью жизни по сравнению с контрольной группой) меньше биоактивность циркулирующего IGF1 (Vitale et al. 2012).
Некоторые нюансы этих исследований были проанализированы экспертами (Sharples et al.2015), и стало понятно, что редкие работы, изучая увеличение срока жизни, принимали также во внимание размер и функцию мышц. Таким образом, физиологический контекст (продолжительность здоровой жизни в противовес просто увеличению срока) часто не учитывался. Два важных исследования лаборатории Блэйка Расмуссена, Dickinson et al. (2011) и Drummond et al. (2009), экспериментально изучали непосредственный эффект рапамицина в мышцах человека (Рис. 4). Первое (Drummond et al. (2009)) показало, что прием рапамицина у человека полностью блокировал способность силовых тренировок увеличивать синтез мышечного белка (Рис. 4a), подтверждая ранее полученные на крысах результаты (Kubica et al. 2005). Второе (Dickinson et al. (2011)) выявило, что рапамицин может также полностью блокировать синтез мышечного белка в ответ на прием незаменимых аминокислот (Рис. 4b). Хотя исследований, посвященных долгосрочным эффектам рапамицина у человека, нет, такие работы на мышах зафиксировали снижение синтеза миофибриллярных протеинов (Drake et al. 2013) и утерю способности накапливать мышечную массу (Bodine et al. 2001). Рапамицин вызывал анаболическую резистентность у молодых и здоровых участников, так что вряд ли подойдет для продления жизни у людей в возрасте, уже испытывающих сложности с сохранением мышц.
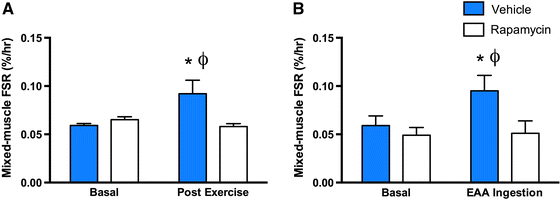
Fig. 4
Снижение активности mTORC1 с помощью рапамицина вызывало анаболическую резистентность у молодых, здоровых мужчин. Было прекращено увеличение синтеза белка после силовых тренировок (a) и приема незаменимых аминокислот (b). Данные a взяты из работы (Drummond et al. 2009); b из работы (Dickinson et al. 2011)
Что же касается ограничения общего калоража, степень этого ограничения и макронутриентный состав имеет критическое значение для сохранения или потери мышечной массы (Cerqueira and Kowaltowski 2010). Например, прием протеиновых добавок при отрицательном энергетическом балансе помогал сохранять мышцы у здоровых людей (Josse et al. 2011; Mettler et al. 2010; Phillips 2014).
Важно отметить, что в исследованиях продолжительности жизни на грызунах проводятся в лабораторных условиях, без естественных перепадов температур, возбудителей болезней и т.д. Мыши не добывают пищу, не борятся за выживание (то есть не используют свою мускулатуру по назначению). Недавнее исследование показало, что в таких условиях они не сохраняют хорошее здоровье и функциональные возможности (Martin et al. 2010). Это приводит нас к важнейшему вопросу: чего мы хоти достичь в этой области биогеронтологии? Увеличить срок жизни с ущербом для здоровья или продлить активную, здоровую жизнь, для которой требуется поддерживать мышечную массу, силу и функцю?
Выводы
Живи сильным и процветай
Как уже было сказано ранее (Ruiz et al. (2008) сохранение физической силы - ключевая стратегия для здоровья в старости. Множество клинических исследований ясно указывает, что активный образ жизни и достаточное потребление белка поддерживает сильную и здоровую скелетную мускулатуру. Важнейшее значение силы и размера мышц для здоровья и продолжительности жизни у человека заставляет нас вспомнить слова Дарвина: "Выживает сильнейший". Люди, поддерживающие физическую форму и силу, живут дольше и сохраняют хорошее здоровье (Artero et al. 2011; Artero et al.; Haskell et al. 2007; Ruiz et al. 2009; Ruiz et al. 2008). Надеемся, учитывая все это, что будущие исследования будут рассматривать мышечную систему в целом и изучать ее функциональные реакции, а не замыкаться на работе отдельных генов или анализе белков. И наконец, что важнее всего, для полного понимания сложных процессов человеческой жизнедеятельности необходимы интеграционные исследования, от простых модельных на животных до детализированных клинических на людях.Оригинал взят у  republicommando в Живи долго и тренируй: значение скелетной мускулатуры для здоровья в пожилом возрасте (Часть 2)
republicommando в Живи долго и тренируй: значение скелетной мускулатуры для здоровья в пожилом возрасте (Часть 2)
Live strong and prosper: the importance of skeletal muscle strength for healthy ageing
Авторы: Michael McLeod, Leigh Breen, D. Lee Hamilton, Andrew Philp
Броперевод:  republicommando
republicommando
Источники
- Оригинал