Задачи к самостоятельной работе
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное образовательное Учреждение высшего образования
«Московский государственный университет технологий и управления имени
К.Г. Разумовского (Первый казачий университет)»
Донской казачий государственный институт пищевых технологий и экономики
(филиал) ФГБОУ ВО «МГУТУ имени К.Г.Разумовского (ПКУ)»
Н.П. Вассель
АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
Анализа
Методические указания и задания по выполнения самостоятельной работы
Ростов - на - Дону
Печатается по решению кафедры химии и биологии ДКГИПТиЭ (филиала) МГУТУ в г. Ростове-на-Дону
Протокол № 8 от 22.04.2016г
Вассель Н.П.
Аналитическая химия и физико-химические методы анализа. Методические указания и задания по выполнению самостоятельной работы Ростов н/Д: электронная версия, 2016.- 18с.
Методические указания и задания по выполнению самостоятельной работыпредназначаются для студентов бакалавриата по направлению подготовки: 19.03.04.
Требования к оформлению самостоятельной работы
Работа состоят из 2 теоретических вопросов и 2 задач. Варианты вопросов и задач определяются по последней цифре шифра студенческого билета или зачётной книжки. Например, если последняя цифра шифра 1 то следует выполнять 1-ый вариант заданий, если 0, то – вариант 0.
Самостоятельная работа выполняется в отдельной тетради ясным и разборчивым почерком. Ответ на теоретический вопрос должен быть подробным, однако его объём не должен превышать двух-трех страниц ученической тетради.
Ответы на вопросы надо искать в следующей литературе.
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с.
4. Вассель Н.П. . Аналитическая химия. Конспект лекций (электронная версия). Ростов н/Д, 2015. – 23 с.
5. Вассель Н.П. Аналитическая химия. Лабораторный практикум. Ростов н/Д: электронная версия, 2016.- 14с. Методические указания предназначены для студентов бакалавриата по направлению подготовки: 19.03.02.
6. Вассель Н.П. Физико-химические методы исследования. Лабораторный практикум (электронная версия). Ростов н/Д, 2016. – 19 с.
Вопросы к самостоятельной работе по аналитической химии
1. Сущность систематического хода анализа. Пользуясь кислотно-основным методом, разделите катионы Fe3+, Ni2+, Zn2+.
2. Ионное произведение воды, водородный показатель, расчет рН растворов кислот и оснований.
3. Определение серной кислоты методом нейтрализации. Индикаторы. Расчет результатов анализа
4. Индикаторы метода нейтрализации, основные теории индикаторов.
5. Перманганатометрия, характеристика метода. Стандартный раствор, установочные вещества
6. Сущность дробного метода анализа. Приведите примеры дробного обнаружения катиона NH 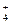 и аниона S2-..
и аниона S2-..
7. Напишите уравнения окисления иона Mn2+ в кислой среде.
8. Использование комплексных соединений для обнаружения и разделения ионов.
9. Напишите уравнения реакций катионов Al3+, Sn2+, Mg2+ и Mn2+ с избытком NaOH.
10. Окислительно-восстановительные реакции в аналитической химии. Окислительно-восстановительные потенциалы. Уравнение Нернста.
11. Классификация методов физико-химического анализа.
12. Сущность рефрактометрического метода анализа. Применение рефрактометрии при исследовании пищевых продуктов.
13. Эмиссионный спектральный анализ. Теоретические основы эмиссионной спектроскопии.
14 Люминесцентный анализ. Общая характеристика метода.
15. Сущность фотоколориметрического анализа.
16. Оптическая плотность. Закон Бугера-Ламберта-Беера.
17. Потенциометрия. Общая характеристика метода.
18. Электроды сравнения, стандартные электроды
19. Хроматография. Основы метода.
20. Классификация методов хроматографии.
Каждый студент отвечает на два вопроса, в соответствии со своим вариантом (см. табл. 1)
Таблица 1.
| Номер варианта | Номера заданий | |
Задачи к самостоятельной работе
1. Вычислите рН раствора HCl, содержащего 3,8059г кислоты в 1 дм3 раствора.
2. Вычислите рН 0,1 М раствора азотной кислоты.
3. Сколько граммов NaOH надо взять для приготовления 100 см3 0,05 н. раствора?
4. Сколько граммов HCl требуется для приготовления 1 дм3 15%-ного раствора?
5. Вычислите концентрацию ионов водорода и рН 0,02 М раствора НСООН (Кдис=1,7·10-4).
6.Для нейтрализации 20 см3 0,1000 н. раствора HCl потребовалось 8,00 см3 NaOH. Определите молярную концентрацию NaOH.
7. До какого объема нужно разбавить 50,0 см3 2н HCl, чтобы превратить его в 0,4н?
8.Из 2,500 г Na2CO3 приготовлено 500 см3 раствора. Рассчитать для этого раствора: а) нормальность; б) молярность.
9. До какого объема нужно разбавить 100,0 см3 2н HCl, чтобы превратить
его в 0,8н?
10. Для нейтрализации 15 см3 0,1000 н. раствора HCl потребовалось 5,00 см3 NaOH . Определите молярную концентрацию NaOH.
11. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [MnO 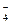 ]=0,1 моль/дм3; [Mn2+]=0,01 моль/дм3, рН=2,0
]=0,1 моль/дм3; [Mn2+]=0,01 моль/дм3, рН=2,0
12. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [MnO 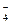 ]=0,1 моль/дм3; [Mn2+]=0,1 моль/дм3, рН=5,0
]=0,1 моль/дм3; [Mn2+]=0,1 моль/дм3, рН=5,0
13. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [MnO 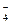 ]=1 моль/дм3; [Mn2+]=0,1 моль/дм3, рН=4,0
]=1 моль/дм3; [Mn2+]=0,1 моль/дм3, рН=4,0
14. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [MnO 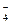 ]=1 моль/дм3; [Mn2+]=1 моль/дм3, рН=3,0
]=1 моль/дм3; [Mn2+]=1 моль/дм3, рН=3,0
15. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]=1 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=3,0
]=1 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=3,0
16. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]=0,1 моль/дм3; [Cr3+]=0,01 моль/дм3, [H+]=0,01 моль/дм3.
]=0,1 моль/дм3; [Cr3+]=0,01 моль/дм3, [H+]=0,01 моль/дм3.
17. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]= [Cr3+]= [H+]=0,01 моль/дм3.
]= [Cr3+]= [H+]=0,01 моль/дм3.
18. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]= [Cr3+]= [H+]=0,001 моль/дм3.
]= [Cr3+]= [H+]=0,001 моль/дм3.
19. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]=0,01 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=3,0
]=0,01 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=3,0
20. Вычислите ОВ – потенциал платинового электрода в растворе, содержащем [Cr2O  ]=1 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=2,0
]=1 моль/дм3; [Cr3+]=0,1 моль/дм3, рН=2,0
Каждый студент решает две задачи, в соответствии со своим вариантом (см. табл. 2)
Таблица 2.
| Номер варианта | Номера заданий | |