Значення закону розподілу для визначення проникності біологічних мембран.
У розподілі речовин в організмі величезну роль грає їх здатність дифундувати через біологічні мембрани. Проте легко проникають через мембрани тільки неіонізовані молекули жиророзчинних речовин.
Здатність таких речовин транспортуватися через мембрани приблизно пропорційна знайденим in vitro (у колбі) значенням коефіцієнтів розподілу цих речовин в системах «масло-вода»: октанол - вода, оливкове масло - вода, хлороформ - вода. Тому коефіцієнти розподілу випробовуваних препаратів в цих системах і їх залежність від кислотності середовища дозволяють прогнозувати можливість проникнення цих препаратів через біологічні мембрани (біологічна доступність) .
5. Способи вираження кількісного складу розчинів.
Найчастіше застосовуються такі способи вираження концентрації розчинів, як масова, молярна, моляльна і нормальна.
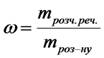
Масова концентрація або масова частка розчиненої речовини (%) виражається числом грамів розчиненої речовини, що знаходиться в 100 г розчину:

Молярна концентрація (молярність) виражається числом молів розчиненої речовини, що міститься в 1л розчину (моль/л). Молярність позначається літерою СМ або М. Наприклад, двохмолярний розчин 2М H2SO4 містить 2 моль кислоти безводної в 1 л розчину. Розчин, який містить в 1 л розчину 0,1 моль/л і 0,01 моль/л речовини, називаються відповідно децимолярним і сантимолярним.

Моляльна концентрація (моляльність) визначається числом молів розчиненої речовини, що міститься в 1 кг розчинника (моль/кг). Наприклад, якщо в 1000 гводи розчинено 98 г H2SO4, то такий розчин одномоляльний. Моляльність позначається Сm:

Якщо маса розчинника виражена в грамах то для розрахунків можна використовувати таку формулу:

Молярна концентрація еквівалентів (нормальна концентрація, нормальність) визначається числом моліі еквівалентів розчиненої речовини, яка міститься в1 л розчину. По аналогії з молярною концентрацією молярну концентрацію еквівалентів, або нормальність виражають в моль/л і позначають Сf, н. або N.

Молярність і нормальність розчинів співпадають для одноосновних кислот і однокислотних основ. Якщо кислота, наприклад, трьохосновна, то нормальність її втричі більша за молярність. 1 М розчину H3РO4 відповідає нормальність цієї кислоти, що дорівнює 3, тобто 1 моль Н3РО4 = 3 моль еквівалентів Н3РО4.
Мольна частка χ
Відношення кількості розчиненої речовини в молях до загальної кількості всіх речовин у розчині (суми числа моль розчиненої речовини і розчинника)

Мольна частка виражається в частках від одиниці.
Раніше мольна частка позначалася буквою N, зараз використовують грецьку літеру χ (капа)
Об’ємна частка φ
Відношення об’єму розчиненої речовини до суми об’ємів усіх компонентів розчину

Об’ємну частку виражають у частках від одиниці або у відсотках
Джерела інформації.
1.Медична хімія (фізична, колоїдна та біонеорганична хімія) / В. I.
Гомонай, Н. П. Голуб, К. Ю. Секереш, А. С. Богоста : посібник до лабораторного практикуму для студентів медичного факультету. -
Ужгород, 2007. – 131 с.
2.Медична хімія : підр. для вузів / В. О. Калібабчук, Л. І. Грищенко, В. І.
Галинська та ін. ; під. ред. В. О. Калібабчук. - К. :Інтермед, 2006. – 460 c.
3.Миронович Л. М. Медична хімія : навч. посібник / Л. М. Миронович,
О. О. Мардашко. – К. : Каравела, 2007. – 168 с.
4.Миронович Л. М. Медична хімія : навч. посібник / Л. М. Миронович. –
К. : Каравела, 2008. – 159 с.
5.Мороз А. С. Медична хімія : підручник / А. С. Мороз, Д. Д. Луцевич, Л.
П. Яворська. - Вінниця : Нова книга, 2006. - 776 с.
6.Музиченко В. П. Медична хімія : підручник / В. П. Музиченко, Д. Д.
Луцевич, Л. П. Яворська ; під ред. Б. С. Зіменковського. – К. :
Медицина, 2010. – 496 с.
7.Порецький А. В. Медична хімія : підручник / А. В. Порецький, О. В.
Баннікова-Безродна,Л. В. Філіппова. – К. : ВСВ «Медицина», 2012. – 384 с.
8.Правила роботи в хімічній лабораторії (інструкція).
9.http://moodle.tdmu.edu.ua/course/view.php?id=132#section-8