Строение вещества. Элементы химической термодинамики и биоэнергетики.
Значение темы:
Изучение темы будет способствовать формированию следующих компетенций ОК–1; ОК–5; ОПК-1; ОПК-7; ОПК-9; ПК-5
Цель: после изучения темыстудент должен
Знать:
ü физико-химическую сущность процессов, происходящих в живом организме на молекулярном, клеточном, тканевом, органном уровнях;
Уметь:
ü пользоваться учебной, научной, научно-популярной литературой, сетью Интернет для профессиональной деятельности;
Вопросы, вынесенные на самостоятельное изучение:
1. Современные представления о природе электрона. Характеристика энергетического состояния электрона с использованием квантовых чисел. Квантово-механическая модель атома.
2. Основные принципы заполнения электронной структуры атома (принцип минимума энергии). Деление атомов по подобию энергетических уровней на s-, p-, d-, f- семейства. Электронные и графические формулы для атомов и ионов.
3. Типы химических связей. Принцип образования ковалентной химической связи.
4. Метод валентных связей. Природа σ- и π-связей. Понятие о гибридизации атомных орбиталей. Взаимосвязь типа гибридизации и структуры молекул.
5. Водородная связь.
6. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное.
7. Зависимость энтальпии процесса от температуры. Энергия Гельмгольца. Уравнения Гиббса-Гельмгольца.
8. Термодинамика открытых систем.
Вопросы для самоконтроля знаний:
1. Запишите электронную формулу для атома хлора. Какие значения примет главное квантовое число для данного элемента? Используя орбитальное и магнитное квантовые числа, определите число подуровней и атомных орбиталей в структуре атома хлора.
2. Напишите электронную, а затем графическую формулы для атома марганца и его иона Mn+7.
3. Запишите электронную формулу для атома хлора. Какие значения примет главное квантовое число для данного элемента? Используя орбитальное и магнитное квантовые числа, определите число подуровней и атомных орбиталей в структуре атома хлора.
4. Напишите электронную, а затем графическую формулы для атома марганца и его иона Mn+7.
5. Приведите примеры соединений, имеющих приведенные в таблице типы гибридизации и геометрическую форму:
| Тип гибридизации | Геометрическая форма | Частицы АВn | Примеры |
| sp | линейная | АВ2 | |
| sp2 | треугольная | АВ3 | |
| треугольная незавершенная | :АВ2; ∙ АВ2 | ||
| sp3 | тетраэдрическая | АВ4 | |
| тетраэдрическая, незавершенная (тригонально-пирамидальная) | :АВ3 | ||
| тетраэдрическая, дважды незавершенная | ::АВ2 ; ∙ : АВ2 | ||
| sp3d | тригонально-пирамидальная | АВ6 | |
| sp3d2 | октаэдрическая | АВ6 | |
| d2sp3 | октаэдрическая | АВ6 |
6. Из приведенных примеров соединений выберите те, которые могут образовывать межмолекулярные и внутримолекулярные водородные связи: H2O, HF, NH3, Cl2, C2H5OH, C2H5C(O)H, C6H4(OH)C(O)OH.
7. Подберите соответствие между типом межмолекулярного взаимодействия и характером взаимодействия:
| Тип межмолекулярного взаимодействия | Характер взаимодействия |
| 1- ориентационное | А - притяжение между неполярными молекулами, в которых может происходить перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи |
| 2 - индукционное | Б - притяжение между постоянным диполем и молекулой с «наведенным» диполем (диполь может индуцировать дипольное распределение зарядов в неполярной молекуле) |
| 3 - дисперсионное | В - притяжение между полярными молекулами, в которых центры тяжести положительного и отрицательного зарядов не совпадают |
Список рекомендуемой литературы:
1 Общая химия./Попков В.А., Пузаков С.А. – М.: ГЭОТАР – Медиа, 2010. –976 с.
2 Общая химия. Биофизическая химия. Химия биогенных элементов. / Под ред. Ю.А. Ершова. - М.: Высшая школа, 2007. – 559 с.
3 Интернет-ресурсы (http://www.chemport.ru/)
Тема № 3.
Химическая кинетика и катализ. Химическое равновесие. Учение о растворах. Коллигативные свойства растворов.
Значение темы:
Изучение темы будет способствовать формированию следующих компетенций ОК–1; ОК–5; ОПК-1; ОПК-7; ОПК-9; ПК-5
Цель занятия: после изучения темыстудент должен
Знать:
ü физико-химическую сущность процессов, происходящих в живом организме на молекулярном, клеточном, тканевом, органном уровнях;
ü основные типы химических равновесий (протолитические, гетерогенные, лигандообменные, окислительно- восстановительные) в процессах жизнедеятельности;
ü электролитный баланс организма человека, коллигативные свойства растворов (диффузия, осмос, осмолярность, осмоляльность);
Уметь:
ü пользоваться учебной, научной, научно-популярной литературой, сетью Интернет для профессиональной деятельности;
ü прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ;
Вопросы, вынесенные на самостоятельное изучение:
1. Виды катализа в биохимических реакциях.
2. Фотохимические реакции.
3. Гомеостаз и его характеристики.
4. Принцип Ле-Шателье, практическое применение.
Вопросы для самоконтроля знаний:
1. Дополните фразы:
ü Кислотно-основный катализ объясняет ферментативную активность участием в химической реакции ……………групп (доноры протонов) и/или ……….. групп (акцепторы протонов). Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как …………, так и …………. К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят Цис, Тир, Сер, Лиз, Глу, Асп и Гис. Радикалы этих аминокислот в протонированной форме -……………, в депротонированной - ……………...
ü Ковалентный катализ основан на атаке нуклеофильных (……………заряженных) или электрофильных (……………..заряженных) групп активного центра фермента молекулами субстрата с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка активного центра фермента. К аминокислотам, участвующим в ковалентном катализе, относят Сер, Тир.
ü Гомогенный катализ - …………………
ü Гетерогенный катализ - ………………..
ü Аутокатализ - …………………………..
ü Промоторы - это вещества……………..
2. Сделайте подпись к графику:
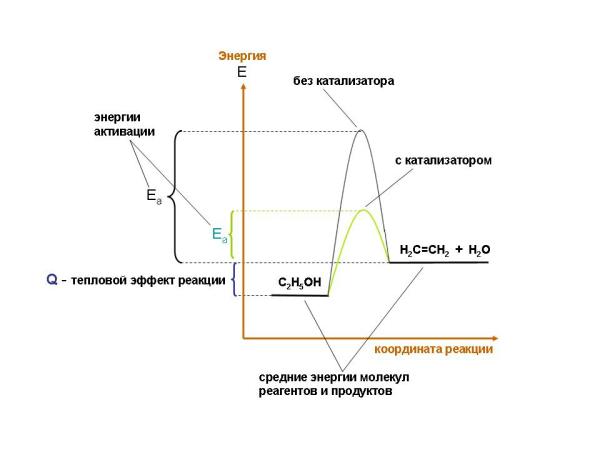
_________________________________________________________________________________
3. Подберите соответствие:
| № | Схема катализа | Механизм катализа | |
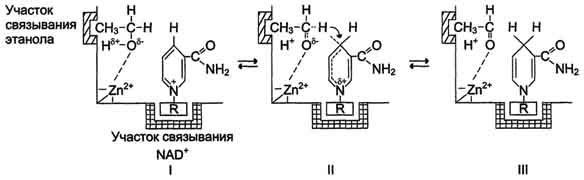
| А - | Ковалентный | |
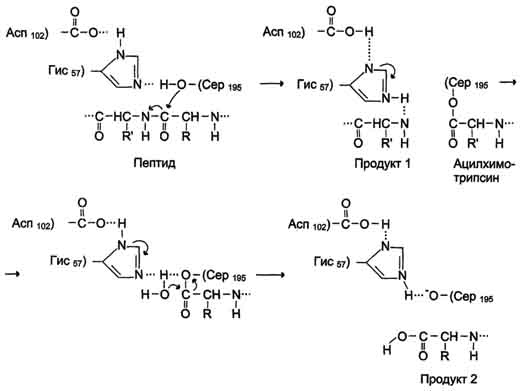
| Б - | Кислотно-основный |
4. Подберите соответствие
| № | Сущность фотохимического процесса | Название процесса | |
| Приобретение или изменение окраски вещества | А - | Фотополимеризация | |
| Возбужденные светом атомы или молекулы передают избыточную энергию другим молекулам | Б - | Фотоизомеризации. | |
| Изменение конформации и структуры молекул | В - | Фотосенсибилизация | |
| Разрыв химических связей с образованием атомов и свободных радикалов. | Г - | Фотохромизм | |
| Образование химических связей | Д - | Фотодиссоциации |
5. Подберите соответствие
| № | Пример фотохимического процесса | Название процесса | |
| Cl2 → 2Cl∙, CH3I → CH3 ∙+ I∙, CH3–N=N–CH3 → 2CH3 ∙+ N2. | А - | Фотополимеризация | |
| Красителем из «обычного» кислорода получают возбужденный кислород, обладающий повышенной реакционной способностью | Б - | Фотоизомеризации. | |
| Образование молекул кислорода из озона, идущие в верхних слоях атмосферы | В - | Фотосенсибилизация | |
| Отвердевание современных пломбировочных материалов | Г - | Фотохромизм | |
| Темнеющее на свету стекло солнечных очков, окон зданий и автомобилей регулирует пропускаемый световой поток, делая его оптимальным | Д - | Фотодиссоциации | |
| Возникновение зрительного сигнала в сетчатке глаза | Е - | Фотосинтез | |
| Фотохимические реакции в зеленых листьях растений и в водорослях |
6. В чем сущность генетического, физиологического, структурного гомеостаза?
7. Сформулируйте правило Ле-Шателье. Выполните тесты с выбором одного правильного ответа.
| Химическое равновесие в системе I2(г) + Cl2(г) = 2ICl(г) + Q не смещается при | |||
| 1) | понижении температуры | 3) | повышении концентрации иода |
| 2) | увеличении давления | 4) | увеличении концентрации хлора |
| Химическое равновесие в системе CO(г) + H2O(г) ↔ CO2(г) + H2(г) смещается в сторону образования продуктов реакции при | |||
| 1) | добавлении катализатора | 3) | понижении концентрации водорода |
| 2) | повышении давления | 4) | понижении давления |
| Химическое равновесие в системе CO2(г) + С(тв) ↔ 2СО(г) – 173 кДж смещается в сторону исходных веществ при | |||
| 1) | повышении давления | 3) | понижении давления |
| 2) | использовании катализатора | 4) | повышении температуры |
| Химическое равновесие в системе N2(г) + O2(г) ↔ 2NO(г) - Q не смещается при | |||
| 1) | повышении давления | 3) | уменьшении концентрации NO |
| 2) | добавлении азота | 4) | повышении температуры |
| Химическое равновесие в системе 2СО(г) ↔ CO2(г) + С(тв) + 173 кДж смещается в сторону образования исходного вещества при | |||
| 1) | повышении температуры | 3) | использовании катализатора |
| 2) | повышении давления | 4) | понижении температуры |
Тема № 4.