Примеры оригинальных и воспроизведенных препаратов
| Оригинальные лекарственные препараты | Воспроизведенные лекарственные препараты |
| Абактал | Пефлоксацин |
| Аспирин (Байер) | Упсарин (Ypsa), ацетилсалициловая кислота |
| Ренитек | Эналаприл,Энап, Рениприл |
| 5-НОК | нитроксолин |
| Вольтарен | Диклофенак, Диклак, Дикловит, Диклонат П, Диклоран |
| Тавегил | клемастин |
| Но-шпа | дротаверина гидрохлорид |
| Мезим-Форте | панкреатин |
| Курантил | Дипиридамол |
| Дифлюкан ( Pfizer) | флюконазол, Дифлазон (КРКА) |
| Дюфалак (SOLVAY PHARMA) | лактулоза |
| Панангин | Аспартам |
| Ноотропил | Пирацетам |
| Клацид | кларитромицин |
| Парлодел (Сандоз) | Бромокриптин |
| Трентал | пентоксифиллин |
| Кавинтон (Гедеон Рихтер,Венгрия) | винпоцетин |
| Омез | Гастрозол, Омепразол, Омипикс, Омитокс |
| Баралгин | анальгин |
ЭКВИВАЛЕНТНОСТЬ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Перевод воспроизведенного препарата в категорию дженериков основывается на соответствии таких показателей как эквивалентность, стабильность, соблюдение производителем требований GMP, соответствие современным фармакопейным требованиям исходных субстанций, готового продукта и упаковки. Доказательство взаимозаменяемости воспроизведенного и оригинального лекарственных препаратов в первую очередь должно быть основано на определении эквивалентности. Различают химическую, фармацевтическую, биологическую и терапевтическую эквивалентность.
Химические эквиваленты – лекарственные препараты, содержащие одни и те же лекарственные вещества (субстанции) в равных дозировках, выпускаемые в одинаковых лекарственных формах, полностью соответствующие по физико-химическим показателям требованиям нормативной документации, но изготовленные различными способами.
Например: Таблетки кислоты ацетилсалициловой 0,5 АОЗТ «Алтайвитамины» производит с применением влажной грануляции, Томский фармацевтический завод – методом прямого прессования.
Мерой химической эквивалентности лекарственных препаратов являются товароведческие показатели (подлинность, количественное содержание лекарственного вещества и т.д.) Химическая эквивалентность не обязательно подразумевает биоэквивалентность лекарственных препаратов, поскольку различия во вспомогательных веществах и процессах производства могут привести к более быстрому или более медленному поступлению лекарственного вещества в кровь.
Фармацевтические эквиваленты – химические эквиваленты, которые обеспечивают одинаковую степень и скорость высвобождения лекарственных веществ из лекарственной формы. Мерой фармацевтической эквивалентности являются показатели фармацевтической доступности (распадаемость, растворение).
Биологические эквиваленты– химические эквиваленты, применение которых обеспечивает одинаковую степень абсорбции (всасывания) лекарственного вещества, которая определяется по содержанию препарата в биологических жидкостях организма. Мерой биологической эквивалентности является биологическая доступность.
Терапевтические эквиваленты – химические эквиваленты, которые при применении проявляют идентичную эффективность в отношении одного и того же заболевания и сопоставимую безопасность для организма.
Мера терапевтической эквивалентности – равноценное изменение симптоматики заболеваний в результате лекарственного вмешательства.
Идеальной мерой измерения эквивалентности лекарственных препаратов является терапевтическая эквивалентность. Однако терапевтическая эквивалентность оценивается достаточно редко, поскольку необходимо учитывать и оценивать многочисленные факторы, включая индивидуальные особенности отдельного организма, стадию развития патологического процесса, степень тяжести и наличие сопутствующих заболеваний. Кроме того, для определения терапевтической эквивалентности необходимо привлечение ряда специалистов, достаточно большого количества аппаратуры и т.д.
На практике наиболее подходящим методом доказательства эквивалентности терапевтического действиялекарственных препаратов, являющихся химическими эквивалентами, является поэтапное определение фармацевтической и биологической эквивалентности, установление которой представляет менее сложную и трудоемкую задачу. В основе данной замены лежит экспериментально установленная тесная корреляционная связь между биологической и терапевтической эквивалентностью, так как существует прямо пропорциональная связь между количеством лекарственного вещества, высвободившимся из лекарственной формы и всосавшимся в кровь, и выраженностью фармакотерапевтического действия.
В связи с вышеизложенным, воспроизведенный лекарственный препарат считается эквивалентным оригинальному, если при прочих равных условиях (доза, способ и кратность введения) он обеспечивает одинаковую с оригинальным препаратом биодоступность (одинаковую степень и скорость всасывания).
БИОЛОГИЧЕСКАЯ ДОСТУПНОСТЬ
В современных биофармацевтических исследованиях в качестве критерия оценки степени влияния фармацевтических факторов на терапевтическую активность лекарственного препарата является биологическая доступность.
Основной задачей определения биологической доступности лекарственных препаратов является обеспечение их максимальной эффективности и предотвращение терапевтической неэквивалентности.
Биологическая доступность (БД) определяется относительным количеством лекарственного вещества, достигшего системного кровотока (степень БД) и скоростью, с которой этот процесс происходит (скорость всасывания), а также продолжительностью нахождения его в определенной концентрации в организме.
Исследование биологической доступности отвечает на вопросы:
• какая часть дозы лекарственного вещества всосалась;
• как быстро происходило всасывание;
• как долго лекарственное вещество находилось в организме;
• в какой концентрации лекарственное вещество распределилось во внутренней среде организма.
Существуют два методаопределения БД: фармакокинетический и фармакодинамический. Фармакокинетический метод основан на измерении изменения концентрации лекарственного вещества в плазме крови во времени или путем определения общего количества лекарственного вещества или его метаболитов, выделившихся с мочой после введения одной или повторных доз.
Фармакодинамический метод основан на измерении фармакодинамических или биохимических реакций на лекарственное вещество или его активные метаболиты. Второй метод является более сложным, поэтому определение БД чаще проводится с помощью фармакокинетического метода.
Степень БД определяют в сравнении со стандартной лекарственной формой, которая хорошо всасывается. При этом использует одинаковые дозы стандартного и исследуемого лекарственного препарата.
Степень БД – это отношение количества неизмененного лекарственного вещества, абсорбированного и обнаруживаемого в крови после его назначения в виде исследуемой лекарственной формы к его количеству в крови после назначения в стандартной лекарственной форме, выраженное в процентах.
Степень БД = 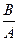 • 100%, где
• 100%, где
В – количество лекарственного вещества, абсорбированное после его назначения в исследуемой лекарственной форме (мг);
А – количество лекарственного вещества, абсорбированное после его назначения в стандартной лекарственной форме (мг).
Различают абсолютную и относительную биологическую доступность. В качестве стандартной лекарственной формы при определенииабсолютной биологической доступности применяют раствор для внутривенного введения, который обеспечивает немедленное и полное поступление лекарственного вещества в большой круг кровообращения. В аннотациях на лекарственные препараты указывается абсолютная БД, зачастую обозначаемая F %. Абсолютная биологическая доступность лекарственных препаратов, применяемых перорально, является оптимальнойпри БД в пределах 40 – 60 %; высокойпри БД более 60 %; низкойпри БД менее 40 %. Например, F % таблеток «Кавинтон», содержащих 0,005 винпоцетина, составляет 70%, таблеток винпоцетина по 0,005 – 54 %.
На практике чаще приходится определятьотносительную БД, в этом случае стандартом является раствор или другая лекарственная форма для перорального приема, которая хорошо изучена и хорошо всасывается.
При исследовании ректальных лекарственных форм за стандартную лекарственную форму при определении относительной БД принимается раствор – клизма, а при низкой растворимости лекарственного вещества – суспензия микронизированного порошка.
Относительную БД определяют при сравнительной оценки взаимозаменяемости оригинального и воспроизведенного лекарственных препаратов, а также при разработке других лекарственных форм лекарственной субстанции. При исследовании биоэквивалентности воспроизведенных препаратов в качестве сравнения используют оригинальный препарат, если он официально зарегистрирован в РФ, или его аналог, если он является наиболее эффективным в данной терапевтической группе. Исследуемые и стандартные препараты являются биоэквивалентными (взаимозаменяемыми), если величина относительной БД находится в пределах от 75 до 125 %.
Таким образом, выбор стандартной лекарственной формы – ответственный этап биофармацевтических исследований, который нельзя проводить произвольно и необоснованно.