V. Болезни, связанные с нарушением белка
КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра молекулярной биологии и медицинской генетики
СРС
На тему: «Изменения белкового состава при онтогенезе и болезнях»
Выполнила: ст. группы 1-032 ОМ
Таскынбай А.Е.
Проверила: Авдиенко О.В.
Караганда 2016г.
Цель: Сформировать общие представления о механизмах изменения белкового состава организма в процессе онтогенеза и при наследственной патологии.
Задачи:
1. Структура, классификация и биологические функции белков.
2. Изучить процессы завершения синтеза белков.
3. Изучить изменения белков организма при наследственных болезнях.
Содержание:
I. Строение белка……………………………………………4 стр.
II. Структура белков…………………………………………4-5 стр.
III. Функции белка………………………………………………6 стр.
IV. Процесс синтеза белка……………………………………..7 стр.
V. Болезни, связанные с нарушением белка……………….8-9 стр.
VI. Заключение ………………………………………………..10 стр.
VII. Список используемой литературы ………………………11 стр.
I. Строение белка
Белки – это сложные высокомолекулярные природные соединения, построенные из 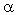 -аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
-аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Число аминокислотных остатков, входящих в молекулы, различно: инсулин – 51, миоглобин – 140. Отсюда Mr белка от 10 000 до нескольких миллионов.
Историческая справка. Первая гипотеза о строении молекулы белка была предложена в 70-х годах XIX в. Это была уреидная теория строения белка. В 1903 г. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским. Эта теория получила подтверждение в последующих работах. Согласно полипептидной теории белки имеют определенную структуру.
(Демонстрация кинофрагмента «Первичная, вторичная, третичная структура белка».)
Многие белки состоят из нескольких полипептидных частиц, которые складываются в единый агрегат. Так, молекула гемоглобина (С738Н1166S2Fe4O208) состоит из четырех субъединиц. Отметим, что Mr белка яйца = 36 000, Mr белка мышц = 1 500 000.
II. Структура белков
Выделяют четыре структуры белка. Первичная структура, представленная на рис. 8.2, представляет собой последовательность аминокислотных остатков, соединенных друг с другом пептидными связями. Именно в таком виде белок образуется на рибосомах.
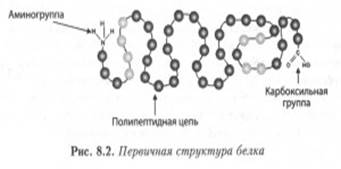
рис. 8.2. Первичная структура белка.
Благодаря образованию водородных связей между радикалами отдельные участки белковой молекулы закручиваются в спираль или формируют складчатый слой. В результате образуется вторичная структура белка (рис 8.3.).
 Рис. 8.3. Вторичная структура белка
Рис. 8.3. Вторичная структура белка
Дополнительные связи определяют формирование третичной структуры белка (рис. 8.4). Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль.

Рис. 8.4. Третичная структура белка
Многие (но не все) белки имеют четвертичную структуру, которая образуется, когда несколько молекул белка, имеющих третичную структуру, взаимодействуют друг с другом через радикалы аминокислот. В результате формируется молекула в виде шара (глобулярные белки) или нити (фибриллярные белки). Белки, которые обладают ферментативной активностью, чаще всего являются глобулярными (рис. 8.5). Структурные белки, например белки, входящие в состав волос или мышц, являются фибриллярными.

III. Функции белков
| Функции белков | Характеристика функций белков | Примеры белков, осуществляющих данную функцию |
| Ферментативная, или каталитичеcкая | Одна из наиболее распространенных функций белков, которая состоит в ускорении химических превращений (синтез и распад веществ; перенос отдельных групп атомов, электронов от одного вещества к другому) | Фумаратгидратаза - катализирует обратимое превращение фумарат + Н2О -> малат Цитохромоксидаза - участвует в транспорте электронов на кислород |
| Гормональная, или регуляторная | Регуляция обмена веществ внутри клеток и интеграция обмена в разных клетках целого организма | Инсулин - участвует в регуляции углеводного, белкового, жирового и других обменов Лютропин - участвует в регуляции синтеза прогестерона в желтом теле яичников |
| Рецепторная | Избирательное связывание различных регуляторов (гормонов, медиаторов, циклических нуклеотидов) на поверхности клеточных мембран или внутри клетки (цитозольные рецепторы) | Цитозольный рецептор эстрадиола - связывает эстрадиол внутри клеток, например слизистой матки Глюкагоновый рецептор - связывает гормон глюкагон на поверхности клеточной мембраны, например печени Регуляторная субъединица протеинкиназы - связывает цАМФ внутри клеток |
| Транспортная | Связывание и транспорт веществ между тканями и через мембраны клетки | Липопротеиды - участвуют в переносе липидов между тканями организма Транскортин - переносит кортикостероиды (гормоны коры надпочечников в крови) Миоглобин - переносит кислород в мышечной ткани |
| Структурная | Участвуют в построении различных мембран | Структурные белки митохондрий, плазматической мембраны и т. д. |
| Опорная, или механическая | Близкая по назначению к структурной. Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур | Коллаген - структурный элемент опорного каркаса костной ткани, сухожилий Фиброин - участвует в построении оболочки кокона шелкопряда -Кератин - структурная основа шерсти, ногтей, копыт |
| Резервная, или трофическая | Использование белков как запасного материала для питания развивающихся клеток | Проламины и глютелины - запасной материал семян пшеницы Овальбумин - запасной белок куриного яйца (используется при развитии зародыша) |
| Энергетическая | Близка к резервной. Белок используется как субстрат (при распаде) для образования энергии. При распаде 1 г белка выделяется 17,1 кДж энергии | Все белки (поступающие или с пищей, или внутриклеточные), которые распадаются до конечных продуктов (СО2, Н2О, мочевина) |
IV. Процесс синтеза белка
Синтез белка - один из основных процессов метаболизма в клетке. Это - матричный синтез. Для синтеза белка необходимы ДНК, иРНК, тРНК, рРНК (рибосомы), аминокислоты, ферменты, ионы магния, энергия АТФ. Основная роль в определении структуры белка принадлежит ДНК.
Участок ДНК, содержащий информацию о структуре определенного белка, называют геном. Ген непосредственного участия в синтезе белка не принимает. Посредником между геном и белком является информационная РНК (иРНК). ДНК играет роль матрицы для синтеза иРНК в ядре клетки. Молекула ДНК на участке гена раскручивается. С одной из ее цепей переписывается информация на иРНК в соответствии с принципом компле- ментарности между азотистыми основаниями нуклеиновых кислот. Этот процесс называют транскрипцией. Транскрипция происходит в ядре клетки при участии фермента РНК-полимеразы и с использованием энергии АТФ.
Синтез белка осуществляется в цитоплазме на рибосомах, где иРНК служит матрицей. Перевод последовательности триплетов нуклеотидов в молекуле иРНК в специфическую последовательность аминокислот называют трансляцией. Синтезированная иРНК выходит через поры в ядерной оболочке в цитоплазму клетки, объединяется с рибосомами, образуя полирибосомы (полисомы). Каждая рибосома состоит из двух субъединиц - большой и малой. иРНК присоединяется к малой субъединице в присутствии ионов магния.

V. Болезни, связанные с нарушением белка
Алиментарная дистрофия - голодная болезнь АЛИМЕНТАРНАЯ ДИСТРОФИЯ (голодная болезнь, безбелковый отек) - болезнь длительного недостаточного питания, характеризующаяся общим истощением, расстройством всех видов обмена веществ, дистрофией тканей и органов с нарушением их функций.
 |
Имеют значение не только абсолютное, но и относительное (непропорциональное выполняемой физической работе) снижение калорийности пищи, качественные изменения пищевого рациона, особенно дефицит белков (главным образом животных), жиров.
При продолжительном недостатке питания возникают гипопротеинемия, дистрофические изменения в различных органах и тканях, нарушается функция многих органов, возникает полигландулярная недостаточность.
Дистрофические изменения в стенке пищеварительного тракта и пищеварительных железах сопровождаются прогрессирующими нарушениями их функций и еще более усугубляют изменения обмена в организме.
Наблюдаются повышенный аппетит и жажда, поли- и поллакиурия, начальные дистрофические изменения в различных органах, изменения психики.
Для III стадии характерны кахексия, полное исчезновение подкожной жировой клетчатки, атрофия мышц, резкая слабость (до полной невозможности совершать самостоятельные движения), апатия, выраженные изменения психики, парестезии, полигиповитаминоз, признаки сердечной, печеночной недостаточности, анемия, мучительные запоры, нередко пролежни.
Течение болезни при отсутствии экстренных мер прогрессирующее вплоть до развития голодной комы.
Анемия (малокровие) - уменьшение гемоглобина в крови. Важнейший показатель болезни - снижение уровня железа сыворотки (норма - 13-28 моль/л для мужчин).
Иммунные комплексы нередко представлены криоглобулинами (комплекс иммуноглобулинов, выпадающих в осадок при температуре ниже 37 С), которые могут циркулировать в крови, откладываться под эндотелием сосудов разных органов и тканей, вызывая развитие генерализованного васкулита, например, болезни Шенлейна - Геноха.
Болезнь наследуется по рецессивному типу, наследование сцеплено с Х-хромосомой.
В начале болезни иногда отмечается небольшое увеличение селезенки, в дальнейшем в связи с повышенным отложением железа в органах развивается гемосидероз печени (печень увеличивается и становится плотной), поджелудочной железы (появляется картина сахарного диабета).
Поскольку синтез нуклеиновых кислот касается всех костномозговых клеток, частыми признаками болезни являются уменьшение числа тромбоцитов, лейкоцитов, увеличение числа сегментов в гранулоцитах.

Болезнь развивается у детей и характеризуется сочетанием областной анемии с поражением почек. Изредка болезнь бывает у взрослых. Причина возникновения наиболее распространенной идиопатической формы болезни не совсем ясна, хотя для многих случаев может быть доказана наследственная природа (рецессивное наследование). Болезнь наследуется по доминантному типу. Внутриклеточный распад эритроцитов определяет клинические проявления болезни - желтуху, увеличение селезенки, анемию, склонность к образованию камней в желчном пузыре, характерные морфологические изменения эритроцитов, ретикулоцитоз.
Первые клинические проявления болезни могут быть в любом возрасте, хотя в действительности она начинается с рождения. Весьма редкий и неспецифический признак болезни - образование трофических язв на голенях.
Трудности диагностики часто обусловлены желчнокаменной болезнью, обычно сопровождающей наследственный микросфероцитоз (из-за образования в протоках и желчном пузыре билирубиновых камней).
Однако в отличие от наследственного микросфероцитоза при них не бывает изменений лицевого черепа, признаков наследственного микросфероцитоза у кого-либо из родителей.
Характерные для наследственного микросфероцитоза изменения выявляются в кислотной эритрограмме: обнаруживаются резкое увеличение устойчивости эритроцитов к действию хлористоводородной кислот.
Болезнь широко распространена в ряде стран Азии и Африки. Особой формой болезни является тяжелый гемолитический криз у новорожденных, клиническая картина которого соответствует резус-конфликту.
VI. Заключение
Таким образом, следует заметить, что функция белков в организме человека является ключевой. Практически во всех процессах, протекающих в организме участвует белок. Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков. Белки - незаменимый строительный материал. Одной из важнейших функций белковых молекул является пластическая. Все клеточные мембраны содержат белок, роль которого здесь разнообразна. Количество белка в мембранах составляет более половины массы. Так как человеческий организм подвергается воздействию внутренних факторов и факторов окружающей его среды, то это сказывается на его белковом составе. Так же белковый состав организма изменяется в ходе его индивидуального развития, и при болезнях. Но природа заложила в организм самостоятельно регулировать собственный белковый состав, что существенно повышает шансы на выживание. Основной инструмент регуляции белкового состава – белковый обмен. Так при ведении здорового образа жизни, соблюдении рационального питания и умеренном воздействии окружающей среды организм сам регулирует свой белковый состав в соответствии с нормой.
VII. Список используемой литературы
1) Биология: в 2 т.: учебник / ред. В. Н. Ярыгин. т. 1, 2012. - 736 с
2) Биология: в 2 т.: учебник / ред. В. Н. Ярыгин. т. 2, 2012. - 560 с.
3) Фаллер, Джеральд М. Молекулярная биология клетки: руководство для врачей: пер. с англ. / Фаллер, Джеральд М., Д. Шилдс, 2011, Бином-Пресс. - 256 с.
4) Молекулярная биология клетки В 3-х т. Т. 1 Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж.
5) Генетика. Учебник для ВУЗов/ Под ред. академика РАМН В.И. Иванова. – М.: ИКЦ «Академкнига», 2006. С.291-307.
6) Казымбет П.К., Мироедова Э.П. Биология. Учебное пособие для студентов медицинских вузов.Часть 1. Астана. 2007. С. 6-21
7) Медицинская биология и генетика/ Под.редакцией Куандыкова Е.У. Алматы, 2004. С.214-217