Стандартная энтальпия образования простых веществ
в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
Числовые значения стандартных энтальпий образования сложных веществ приводятся в справочниках.
Энтальпию реакции можно определить как экспериментально, так и методом расчета с использованием стандартных энтальпий образования веществ, участвующих в химической реакции, на основе закона, открытого академиком Российской академии наук Г. И. Гессом (1840).
Закон Гесса
Энтальпия реакции, т. е. тепловой эффект реакции, зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которому протекает реакция.
В термохимических расчетах большое значение имеют следствия из закона Гесса.
Первое следствие
Энтальпия реакции равна разности алгебраической суммы энтальпий образования всех продуктов реакции и алгебраической суммы энтальпий образования всех исходных веществ: 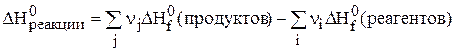
Второе следствие
Тепловой эффект реакции при стандартных условиях равен разности между суммой энтальпии сгорания исходных веществи суммой энтальпии сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
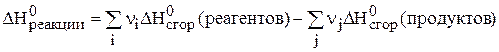
Стандартной теплотой (энтальпией) сгорания называется энергия, которая выделяется при сгорании в атмосфере кислорода 1 моль вещества до простейших оксидов (СО2, Н2О, SO2) при стандартных условиях.
Закон Лавуазье-Лапласа (3-е следствие из закона Гесса):
Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком. 
Основным источником энергии для живых организмов является химическая энергия, заключенная в продуктах питания. Для человека главными компонентами пищи являются жиры, углеводы и белки, окисление которых сопровождается выделением энергии. В медицине энергетическую характеристику продуктов питания принято выражать в калориях. Пища обычно представляет собой смесь питательных веществ сложного состава, поэтому калорийность пищи указывается в расчете на 1 г, а не на 1 моль.
Калорийностью питательных веществ называется энергия, выделяемая при полном окислении (сгорании) 1 г питательных веществ.
Взаимосвязь между единицами энергии выражается соотношением:1 калория = 4,18Дж.
Наибольшую энергетическую ценность имеют жиры, при окислении которых выделяется 37,7-39,8 кДж/г (9,0-9,5 ккал/г). В процессе усвоения углеводов в организме человека выделяется 16,5— 17,2 кДж/г (4,0—4,1 ккал/г). На этом же уровне находится и калорийность белков: 16,5-17,2 кДж/г (4,0-4,1 ккал/г).