ФОТОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЕ ДНК.
ИП №6 от 14 июня 2007 г.
КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра медицинской биофизики и информатики
Лекция
Тема:Физические основы интроскопии
Дисциплина ООD 012 МВ 1112 «Медицинская биофизика»
Специальность 5В130100-«Общая медицина»
Курс – 1
Время (продолжительность) 1ч.
Караганда 20015 г.
Обсуждена и утверждена на заседании кафедры
"____"__________200___г. Протокол №_____
Заведующий кафедрой проф. ______________ Б.К. Койчубеков
Тема:Физические основы интроскопии
Подтема:Фотохимические превращения ДНК
Цель: Показать механизмы действия световых волн различных диапазонов на биологические системы. Определить возможности определения биологического эффекта действия. Показать особенности взаимодействия различных биологически активных соединений с УФ-излучением. Выяснить механизмы защиты от повреждающего действия Уф-излучения.
ПЛАН лекции
1.ПЕРВИЧНЫЕ ФОТОХИМИЧЕСКИЕ РЕАКЦИИ БЕЛКОВ.
2. ФОТОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЕ ДНК.
2.1 Реакция фотодимеризации.
2.2. Реакция фотогидратации.
2.3. Образование (6-4) пиримидиновых аддуктов.
2.4 Сшивки с белком.
2.5. Особенности действия высокоинтенсивного лазерного УФ-излучения на ДНК (двухквантовые реакции)
Тезисы лекции:
ПЕРВИЧНЫЕ ФОТОХИМИЧЕСКИЕ РЕАКЦИИ БЕЛКОВ.
В настоящее время доказано, что основной первичной фото-реакции триптофана (АН) в белке является его фотоионозация с образованием катион-радикала и сольватированого электрона:
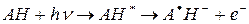 [1]
[1]
При комнатной температуре эта реакция протекает за 5-20 мкс и исследована с использованием метода флеш-фотолиза. Показано, что через 5 мкс после Уф облучения в растворе триптофана появляются характерные спектры поглощения в красной и дальней красной области спектра, которые принадлежат выбитому сольватированному электрону, т.е. электрону, «выбитому» из молекулы аминокислоты и захваченному дипольными молекулами растворителями. Сольватированный электрон быстро реагирует с другими молекулами, в частности, с молекулами растворителя и, вследствие чего полоса его поглощения исчезает. Однако, если облучать замороженные образцы триптофана при температуре жидкого азота ( в этих условиях сольватированные электроны не рекомбинируют), то поглощение сольватированого электрона (максимум при 600 нм) можно зарегистрировать и на обычном спектрофотометре. Кроме того, наличие некомпенсированного магнитного момента (спин) у сольватированного электрона позволяет обнаружить его методом ЭПР.
ФОТОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЕ ДНК.
Согласно общепринятому мнению, ДНК основная внутриклеточная мишень при летальном и мутагенном действии коротковолнового УФ излучения. Это в частности, подтверждается совпадением максимума в спектрах действия фотобиологических эффектов (260-265 нм) с максимумом в спектре поглощения ДНК. Основными хромофорами ДНК являются азотистые основания нуклеотидов, причем квантовые выходы фотопревращений пирими-диновых компонентов примерно на порядок выше, чем пуриновых. Поглощение азотистыми основаниями квантов Уф света ( максимум поглощения при 260 нм) приводит к образованию их электронно-возбужденных синглетных и триплетных состояний, которые возникают за счет p–p*-переходов. Электронно-возбужденные состояния пиримидиновых оснований могут вступать в ряд фотохимических реакций, из которых, биологически наиболее важны три реакции присоединения: димеризация, гидратация и образования сшивок с белком.
Реакция фотодимеризации.
Эта реакция впервые была обнаружена при Уф облучении замороженных растворов тимина. Она состоит в соединении двух оснований по 5,6-двойной углеродной связи с образованием кольца циклобутанового типа:
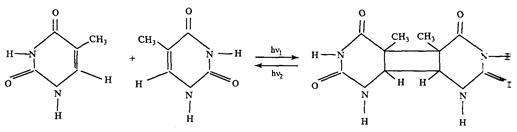 |
Характерная черта реакции димеризации ее обратимость. Пиримидиновые основания поглощают свет в области 200-300 нм, их димеры примерно в том же диапазоне УФ-спектра (200-285 нм).Поэтому при Уф облучении оснований или ДНК для каждой длины волны возбуждающего света между димерами и основаниями устанавливается динамическое равновесие, определяемое соотношением поперечных сечений димеризации оснований и мономеризации димеров. Так, в случае облучения тимина при 200 нм димеризуется около 65% оснований, а при 280-15%.
Вследствие бимолекулярного характера реакций фотодимеризации ее квантовый выход существенно зависит от степени взаимоориентации мономеров при возбуждении одного из них. Например, квантовый выход димеризации тимина в водном растворе при комнатной температуре - 4,7×10-4, а в замороженном - 1. Квантовый выход димеризации тимина в ДНК - 2×10-2. В соответствии с проведенными расчетами условия для димеризации тимина в ДНК являются оптимальными, если соседние мономеры ориентированы друг к другу под углом в 36 .
Некоторые красители акридинового ряда могут эффективно уменьшать выход УФ- индуцированных димеров в ДНК. Защитное свойство акридинов основано на их способности интеркалировать между парами оснований в молекуле ДНК. Характерная черта взаимодействия акридинов (например акридиновый оранжевый) с ДНК заключается в том, что при образовании комплекса резко увеличивается интенсивность флуоресценции красителя в максимуме спектра при 530 нм. По мнению некоторых авторов, это может быть обусловлено синглет-синглетной миграцией энергии возбуждения с оснований на краситель. Расчеты показывают, что максимальный квантовый выход такой миграции энергии достигается при соотношении 1 молекула красителя / 5 оснований и составляет 32%.
Помимо увеличения интенсивности флуоресценции тестом на связывание акридинов с ДНК может служить так же изменение степени поляризации люминесценции, зависящей от подвижности молекул красителей. С помощью этого метода показано, в частности, что плоскость кольца акридинового оранжевого перпендикулярна длинной оси спирали ДНК и параллельна плоскостям оснований.
Реакция фотогидратации.
Этот процесс - вторая важная фотохимическая реакция пиримидиновых оснований ДНК, которая заключается в присоединении воды к пиримиддиновым основаниям ДНК, которая заключается в присоединении воды к пиримидиновому кольцу у С 5(Н) и С6(ОН) углеродных атомов с разрывом двойной связи между ними и образованием 6-окси-5-гидропроизводных оснований.
 |
В отличие от димеризации реакция гидратации не является фотообратимой. Однако гидраты могут разрушаться при повышении температуры (>30 50 0С) и ионной силы раствора, а так же при сдвигах рН. Скорость фотогидратации уменьшается при замене Н2О на Д2О. Предшественниками гидратов пиримидинов являются видимо, их синглетные возбужденные состояния. В пользу этого свидетельствуют следующие данные: триплетные тушители не влияют на фотогидратацию, квантовый выход реакции не зависит от длины Уф света, хотя вероятность конверсии в триплетное состояние зависит от нее, избирательное фотосенсибилизированное заселение триплетных уровней оснований не приводит к их гидратации. Особенность реакции фотогидратации заключается в том, что она протекает только в одно-цепочной ДНК. Поэтому гидраты пиримидинов могут вносить вклад в летальный или мутагенный эффект лишь у клеток с активным процессом репликации и транскрипции, в ходе которых появляются короткие одно-цепочные участки ДНК.