Аналитические реакции, условия проведения реакций
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное образовательное Учреждение высшего образования
Московский государственный университет технологий и управления имени
К.Г. Разумовского (Первый казачий университет)»
Донской казачий государственный институт пищевых технологий и экономики
(филиал) ФГБОУ ВО «МГУТУ имени К.Г.Разумовского (ПКУ)»
Н.П. Вассель
Аналитическая химия и физико-химические методы анализа
Конспект лекций
Ростов-на-Дону
Печатается по решению кафедры химии и биологии ДКГИПТиЭ (филиала) МГУТУ в г. Ростове-на-Дону
Протокол № 8 от 22.04.2016г
Вассель Н.П
Аналитическая химия и и физико-химические методы анализа. Конспект лекций. Ростов н/Д: электронная версия, 2016.- 35с.
Конспект лекций предназначается для студентов бакалавриата
направлений подготовки 19.03.04 «Технология продукции и организация общественного питания».
Аналитическая химия – дисциплина, которая развивает и применяет методы, средства для получения информации о составе и природе вещества.
Аналитическая химия состоит из двух разделов: качественный химический анализ и количественный химический анализ.
При помощи качественного анализа устанавливают, из каких элементов, ионов, атомов, атомных групп, молекул состоит исследуемое вещество.
Задачами количественного анализа является определение количественного содержания химических элементов, ионов, атомов, групп или химических соединений, входящих в состав исследуемых веществ и материалов.
Качественный химический анализ включает дробный и систематический анализ. Дробный анализ – обнаружение иона или вещества в анализируемой пробе с помощью специфических реагентов в присутствии всех компонентов пробы. Систематический анализ предусматривает разделение смеси анализируемых ионов на аналитические группы при помощи групповых реагентов с последующим обнаружением каждого иона. Существуют различные аналитические классификации катионов по группам: сульфидная (сероводородная), аммиачно-фосфорная, кислотно-основная. Количественный химический анализ включает гравиметрические (весовые) и титриметрические (объемные) методы.
Задачи как качественного, так и количественного анализов могут быть разрешены с помощью различных методов: химических, физических и физико-химических.
Аналитические реакции, условия проведения реакций
При химических методах открываемый элемент или ион переводят в какое-либо новое соединение, обладающее характерными свойствами, на основании которых можно установить образование этого соединения.
Ag+ + Cl- =AgCl↓ (белый)
Происходящие при этом превращения называются химическими аналитическими реакциями, а вещества их вызывающие – реактивами или реагентами.
В качестве аналитических реакций чаще всего используют реакции образования окрашенных соединений, выделение или растворение осадков, газов, образование кристаллов характерной формы, окрашивание пламени газовой горелки, образование люминесцирующих соединений, т.е. образование продуктов реакции с аналитическими признаками.
На результаты проведения аналитических реакций влияют температура, концентрация растворов, рН среды, присутствие других веществ (мешающих, маскирующих, катализирующих процессы). Например, осадки, растворимые в кислотах, не могут образоваться в растворе при наличии в нем избытка свободной кислоты, а осадки, растворимость которых сильно возрастает с повышением температуры, не могут быть получены из горячего раствора.
Очень важным условием течения реакции является достаточная концентрация открываемого иона в растворе, превышающая некоторый минимальный предел.
Предел обнаружения (открываемый минимум) – наименьшая масса определяемого вещества, однозначно открываемого данной аналитической реакцией в минимальном объеме предельного раствора - m (мкг).
Аналитическая реакция тем чувствительнее, чем меньше ее открываемый минимум.
Аналитические реакции и аналитические реагенты часто подразделяют на специфические (специфичные, характерные), селективные (избирательные) и групповые.
Специфические реагенты и реакции позволяют обнаружить данное вещество или данный ион, в присутствии других веществ или ионов. Например, в качестве специфического реагента на ионы аммония используют щелочь, при подогреве выделяется специфический запах аммиака.
Специфических аналитических реагентов и реакций известно очень мало.
Селективные реагенты и реакции позволяют обнаруживать несколько веществ или ионов. Таких реагентов известно значительно больше, чем специфических.
Групповые реагенты и реакции (частный случай селективных) позволяют обнаруживать ионы определенной аналитической группы. Например, серная кислота H2SO4 и растворимые сульфаты (Na2SO4, K2SO4 и т.д.) являются групповыми реагентами на группу двухвалентных катионов: кальция Са2+, бария Ва2+, стронция Sr2+
Ca2+ + SO 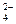 = CaSO4↓ белый
= CaSO4↓ белый
Ba2+ + SO 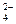 = BaSO4↓ белый
= BaSO4↓ белый
Sr2+ + SO 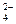 = SrSO4↓ белый
= SrSO4↓ белый
Гравиметрический анализ
При количественном гравиметрическом химическом анализе определяют массу искомого компонента анализируемого образца путем точного взвешивания массы устойчивого конечного вещества известного состава, в которое полностью переведен данный определяемый компонент.
Гравиметрические химические методы делятся на методы осаждения и отгонки.
При методах осаждения определяемый компонент при помощи реагента (осадителя) количественно переводится в малорастворимое соединение, например:
a) Fe3+ + 3NH4OH = Fe (OH)3 ↓ + 3NH4+
b) Ba2+ + SO 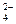 = BaSO4↓
= BaSO4↓
Образующийся осадок определяют, промывают, высушивают (BaSO4) или прокаливают t0
2Fe(OH)3 = Fe2O3 + 3H2O
до постоянной массы и взвешивают.
При методах отгонки определяемый компонент выделяют из анализируемого пробы в виде газообразного вещества и измеряют либо массу остатка (косвенный метод), либо массу отогнанного вещества (прямой метод).
Данные методы применяются в пищевой промышленности для определения содержания воды (влажности) и летучих компонентов в продуктах питания.