Тема 1.4.2 Диаграммы состояния двойных сплавов
Тема 1.4 Теория сплавов
Тема 1.4.1 Общие сведения из теории сплавов
Чистые металлы во многих случаях не обеспечивают требуемых свойств, поэтому они применяются сравнительно редко. Более широко используются металлические сплавы.
Сплав – вещество, состоящее из двух и более элементов.
Система – совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление).
Фаза – однородная по химическому составу и внутреннему строению часть системы.
Компоненты – вещества образующие систему.
В большинстве случаев входящие в сплав элементы в жидком состоянии полностью растворимы друг в друге, т.е. представляют собой жидкий раствор (рисунок 1, а). В процессе кристаллизации сплава могут образовываться следующие типы сплавов: твердые растворы (рисунок 1, б), химические соединения (рисунок 1, в)и механические смеси (рисунок 1, г).
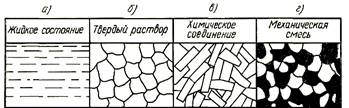
|
Рисунок 1
Сплавы имеют более сложное строение, чем чистые металлы, поэтому процессы их кристаллизации сложнее и отличаются от процессов кристаллизации металлов.
Основное отличие кристаллизации сплавов от кристаллизации чистых металлов состоит в том, что сплавы кристаллизуются не при одной строго определенной температуре, а в интервале температур, т.е. от температуры начала кристаллизации до температуры конца кристаллизации (кроме эвтектики).
Таким образом, металлы при кристаллизации имеют одну критическую точку, а сплавы две (кроме эвтектики).
Эвтектика – сплав, который является механической смесью двух структур, выделяющихся одновременно при постоянной температуре (самой низкой для данной системы) и определенной концентрации сплава.
Тема 1.4.2 Диаграммы состояния двойных сплавов
Правило фаз или закон Гиббса. Состояние сплава зависит от внешних условий (температуры, давления) и характеризуется числом и химическим составом образовавшихся фаз. Возможность изменения внешних условий без изменения числа фаз, находящихся в равновесии, называется вариантностью или числом степеней свободы системы. Правило фаз определяет взаимосвязь между числом степеней свободы, числом компонентов и числом фаз, находящихся в равновесии:
С = К + 1 – Ф ,
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз, находящихся в равновесии;
1 – число внешних факторов (температура).
Если двухкомпонентная система находится в расплавленном состоянии (К=2, Ф=1), то имеем две степени свободы (С=2), т.е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы.
Для той же системы при наличии двух фаз (жидкой и твердой) имеем К=2, Ф=2 и С=1, т.е. систему моновариантную (одновариантную). С изменением температуры концентрация должна быть строго определенной.
Для той же системы при наличии трех фаз имеем К=2, Ф=3 и С=0, т.е. систему нонвариантную (безвариантную). Сплав из данного числа фаз может существовать только при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
Диаграмма состояния сплавов системы свинец – сурьма
Рассмотрим построение диаграммы системы «Pb – Sb» (рисунок 2). К системе сплавов свинец сурьма относятся все сплавы между чистым свинцом и чистой сурьмой.
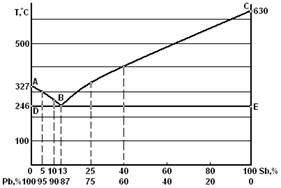
Рисунок 2 – Диаграмма состояния сплавов системы «Pb – Sb»
Кривые охлаждения компонентов и сплавов представлены на рисунке 3.

Рисунок 3 – Кривые охлаждения сплавов системы «Pb – Sb»
Линия ABC – линия ликвидуса (ликвидус – от лат. «жидкий»). Ниже линии DBE все сплавы системы находятся в твердом состоянии. Линия DBE – линия солидуса (солидус – от лат. «твердый»).
В точке В при массовом содержании 13 % Sb, 87 % Pb и при температуре 246 °С кристаллизация свинца и сурьмы происходит одновременно; образуется тонкая механическая смесь кристаллов свинца и сурьмы (двух фаз). Эта смесь называется эвтектикой (эвтектика – от греч. «легкоплавящийся»).
Правило отрезков.Впроцессе кристаллизации изменяется химический состав фаз и их масса (масса жидкости уменьшается, а твердой фазы — увеличивается, при этом, естественно, суммарная масса фаз остается постоянной, равной массе сплава).
Правило отрезков служит для определения химического состава фаз (т.е. содержания в них компонентов) и массового соотношения фаз в любой точке двухфазных областей диаграммы. Для их определения через точку, характеризующую положение сплава на диаграмме, проводят горизонтальную линию (коноду)до пересечения с линиями диаграммы, ограничивающими двухфазную область, в которой лежит заданная точка. Проекция точки пересечения коноды и линии диаграммы состояния на ось концентраций показывает состав той фазы, с которой граничит точка пересечения. Так, т. а' определяет концентрацию компонентов в жидкой фазе, а т. с' — концентрацию компонентов в твердой фазе (рисунок 4).

Рисунок 4 – Структурная диаграмма сплавов системы «Pb – Sb»
Для определения количественного соотношения фаз пользуются правилом рычага. Все количество сплава соответствует отрезку ас. Количество соответствующей фазы определяется противолежащим отрезком: количество жидкости — отрезком bс, а твердой фазы — отрезком ab.