Что делать, если не стыкуется
Сначала поговорим о мисматч-репарации (DNA mismatch repair). Ей не повезло даже с названием: терминология в этой области складывалась в конце 1980-х, когда в России с наукой было не всё в порядке, поэтому общепринятого термина не существует — кто-то просто копирует английское mismatch repair(слово mismatch в английском языке обозначает неправильную, неподходящую пару, мезальянс), кто-то использует названия «репарация гетеродуплексов», «репарация неканонических пар оснований»... В любом случае, это система, которая исправляет ошибки ДНК-полимераз, если те включают в ДНК при синтезе не те нуклеотиды, что нужно, — образуют не пары A:T и G:C, а что-то другое, например G:T. Такое случается редко, но всё же случается, потому что ни один фермент не работает со стопроцентной точностью.
Главная проблема при исправлении таких ошибок ДНК-полимераз — не то, как удалить неправильно включенный нуклеотид, а как узнать, что он неправильно включен. В самом деле, до этого мы говорили о поврежденных звеньях ДНК — их структура отличается от нормальной, и их каким-то образом можно распознать. А как быть в случае, когда оба нуклеотида нормальные, но друг другу не соответствуют? Какой из них был в исходной ДНК, в материнской цепи, а какой был неверно включен в дочернюю цепь?
Многие бактерии решают эту проблему, маркируя материнскую цепь при помощи метильных групп, которые специальный фермент, ДНК-метилаза Dam, вводит в основания аденина, находящиеся в последовательностях -GATC-. Таким образом, сразу после синтеза ДНК эта последовательность на протяжении нескольких минут остается полуметилированной — то есть несет метильные группы в материнской цепи и не содержит их во вновь синтезированной дочерней цепи. Этого времени системе мисматч-репарации достаточно для того, чтобы сработать. У человека механизм, различающий материнскую и дочернюю цепь, другой и более сложный, основанный на асимметричном связывании некоторых белков при репликации, — но он всё равно существует, мисматч-репарация без такого механизма работать не может.
Как именно развиваются события после маркировки цепей метильными группами — вот главный вклад Пола Модрича в исследования репарации ДНК. К тому времени, когда Модрич начал работать в этой области, ситуация напоминала ту, в которой оказался Санджар: были известны гены, которые необходимы для репарации (mutH, mutL и mutS), было понятно, что различение материнской и дочерней цепей основано на метилировании, но никто понятия не имел, что и как делает каждый белок в этом пути. Модрич придумал элегантную систему, основанную на образовании дуплексов между цепочками ДНК бактериофагов, отличающихся на один нуклеотид, что позволило ему проследить судьбу неправильных пар нуклеотидов в деталях — и с изолированными белками системы репарации, и в клетках бактерий. Как оказалось, процесс начинается с того, что сразу после репликации с полуметилированными последовательностями -GATC- связывается белок MutH. Одновременно с неправильной парой нуклеотидов связываются две молекулы белка MutS. Забавно, что, когда ученые в 2000 году определили структуру MutS, две молекулы белка оказались очень похожими на сложенные в молитве ладони, между которыми зажата ДНК. Когда расстояние между MutH и димером MutS позволяет им взаимодействовать (в чем им помогает третий член системы, MutL), белок MutH превращается в эндонуклеазу, которая расщепляет неметилированную цепь в последовательности -GATC-. Начиная с этого разрыва дочерняя цепь ДНК затем удаляется в направлении связанного белка MutS. Достигнув неправильной пары оснований, разрушение ДНК останавливается, после чего недостающий участок ДНК вновь синтезируется.
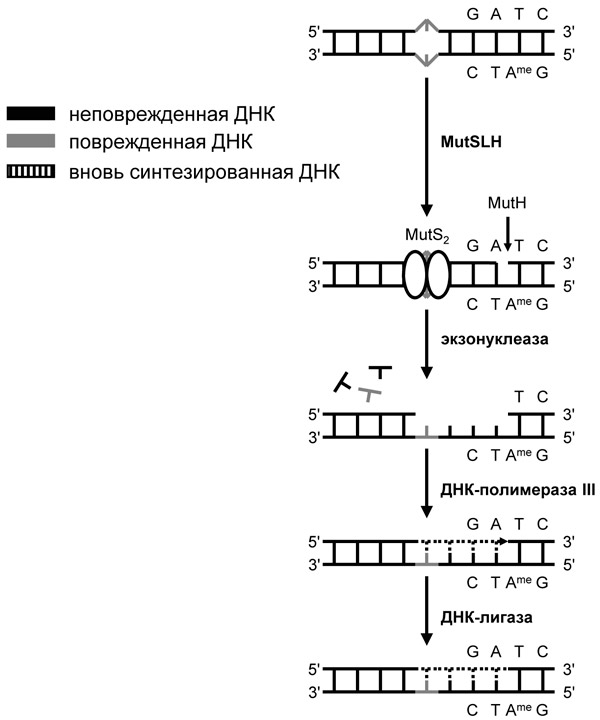 Рис. 3. Мисматч-репарация. Димер белка MutS узнает неправильную пару нуклеотидов, а белок MutH – полуметилированный участок -GATC-. Затем MutH вносит разрыв в неметилированную цепь, которая считается дочерней, и участок ДНК вплоть до неправильной пары удаляется и синтезируется вновь
Рис. 3. Мисматч-репарация. Димер белка MutS узнает неправильную пару нуклеотидов, а белок MutH – полуметилированный участок -GATC-. Затем MutH вносит разрыв в неметилированную цепь, которая считается дочерней, и участок ДНК вплоть до неправильной пары удаляется и синтезируется вновь
|
В лаборатории Пола Модрича были открыты основные принципы мисматч-репарации и у бактерий, и у человека. Система мисматч-репарации у нас очень похожа на бактериальную, за исключением принципа определения материнской и дочерней цепи. Мутации в генах, ответственных за мисматч-репарацию, приводят к развитию наследственного рака кишечника и служат самой распространенной причиной этого заболевания.
Самая важная система
Обратимся, наконец, к третьей главной системе репарации — эксцизионной репарации оснований. Вообще-то, ее следовало бы назвать первой, по крайней мере по значению, ибо она устраняет подавляющее большинство всех повреждений. К ним относятся как раз те, которые неизбежно возникают в ДНК под действием воды и кислорода, но и многие другие повреждения тоже ею исправляются. Если поломки в других системах репарации вызывают тяжкие болезни, неисправность эксцизионной репарации оснований у человека, за редкими исключениями, в заболеваниях не проявляется — такие дети просто не рождаются, эмбрионы гибнут на самых ранних стадиях.
Наверное, в эксцизионной репарации оснований самое интересное то, что она была открыта, что называется, «на кончике пера». Как когда-то французский астроном Урбен Леверье задумался над возмущениями орбиты Урана и открыл Нептун, так в начале 1970-х годов Томас Линдаль задумался над химической реактивностью ДНК и открыл новый механизм ее репарации. Сам Линдаль утверждает, что его вдохновила знаменитая «Белая книга» — переведенная на английский язык монография «Органическая химия нуклеиновых кислот» академика Н. К. Кочеткова с соавторами, ставшая настольной книгой во многих биохимических лабораториях мира. Прочитав ее, биолог Линдаль понял, что представление о ДНК, как химически устойчивой молекуле, которая лишь изредка повреждается под влиянием ультрафиолета, радиации или химических мутагенов, в корне неверно — ДНК в водной среде повреждается постоянно. Выбрав две простых и легко идущих химических реакции — превращение цитозина в урацил (который в норме встречается в РНК, но не в ДНК) и апуринизацию (отщепление от ДНК аденина или гуанина), — Линдаль быстро показал, что они протекают и в изолированной ДНК, и в живой клетке. Более того, получив ДНК, в которой часть цитозина была заменена на урацил, он обнаружил и фермент, который удалял урацил в виде свободного основания —урацил-ДНК-гликозилазу (Uracil DNA glycosylases) — и новый вид репарации был открыт.
По пути эксцизионной репарации оснований происходит репарация небольших поврежденных оснований и апуринизированных нуклеотидов, которые не вносят значительных искажений в структуру ДНК и поэтому не узнаются системой эксцизионной репарации нуклеотидов. Сначала поврежденное основание узнается одним из ферментов, относящимся к классу ДНК-гликозилаз (DNA glycosylase), которые выщепляют его из ДНК. ДНК-гликозилазы обладают групповой специфичностью — некоторые удаляют из ДНК только окисленные пуриновые основания, другие — окисленные пиримидины, третьи — алкилированные основания, четвертые — урацил и т. п. После этого фермент АП-эндонуклеаза разрывает ДНК рядом с повреждением, ДНК-полимераза встраивает один (так называемая «короткозаплаточная репарация») или несколько нуклеотидов («длиннозаплаточная репарация»), и репарация завершается ДНК-лигазой. В процессе эксцизионной репарации оснований участвуют еще несколько белков, но они играют вспомогательную роль.
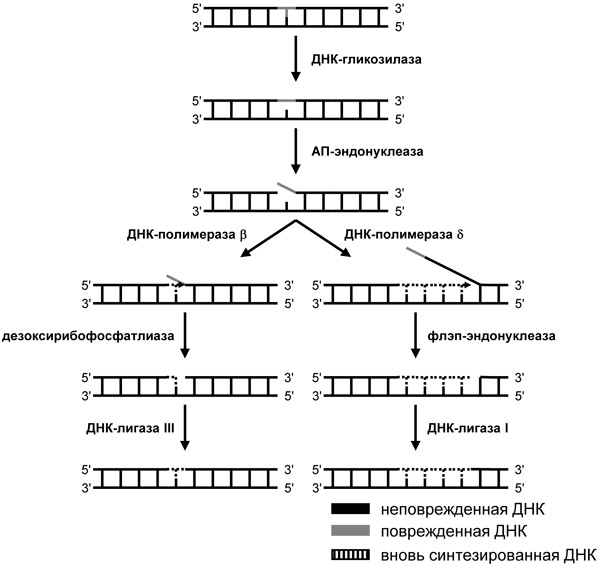 Рис. 4. Эксцизионная репарация оснований. ДНК-гликозилаза вырезает поврежденное основание, затем АП-эндонуклеаза разрывает поврежденную цепь ДНК, а далее в зависимости от участвующей ДНК-полимеразы вытесняются один или несколько нуклеотидов поврежденной цепи с одновременным синтезом нового участка ДНК
Рис. 4. Эксцизионная репарация оснований. ДНК-гликозилаза вырезает поврежденное основание, затем АП-эндонуклеаза разрывает поврежденную цепь ДНК, а далее в зависимости от участвующей ДНК-полимеразы вытесняются один или несколько нуклеотидов поврежденной цепи с одновременным синтезом нового участка ДНК
|
В последние годы выяснилось, что природа, которая любит использовать готовые решения, приспособила эксцизионную репарацию оснований не только для ремонта ДНК, но и для, казалось бы, совсем посторонних вещей. Например, ту же урацил-ДНК-гликозилазу клетки человека используют для борьбы с вирусами, в частности с ВИЧ. Существует специальный ферментAPOBEC, который в вирусной ДНК массово превращает цитозин в урацил, а урацил-ДНК-гликозилаза потом такую ДНК расщепляет. Иммунный ответ также требует участия урацил-ДНК-гликозилазы, которая в этом случае отвечает за генерацию разнообразия антител. Эксцизионная репарация оснований лежит в основе эпигенетических процессов — направленной модификации ДНК, которая регулирует активность генов. В раковых клетках некоторые пути репарации выключены — и ингибиторы оставшихся путей, главным образом эксцизионной репарацию оснований, сейчас рассматриваются как новые многообещающие лекарства в онкологии.
Помимо множества собственных открытий, Томас Линдаль сослужил огромную службу науке и тем, что воспитал многих учеников. Через его лабораторию в лондонском Клэр-Холле (Clare Hall laboratories) прошла чуть ли не половина современных лидеров в области репарации ДНК. В июне этого года в честь Линдаля была организована конференция, на которую многие из них съехались со всего мира, и научный уровень ее был, наверное, самым высоким, который только доводилось видеть автору этих строк.
За рамками премии
Неправильно было бы умолчать о том, что репарация ДНК — одно из направлений, в котором российские ученые могут и сейчас достойно поспорить с мировыми классиками. Впрочем, сейчас слово «поспорить» здесь неуместно: исторически сложилось так, что репарация — это такая область, в которой жесткая конкуренция непопулярна, напротив — ведущие лаборатории тесно сотрудничают. В России основные исследования репарации ДНК ведутся в нескольких лабораториях Института химической биологии и фундаментальной медицины СО РАН в Новосибирске; есть группы, работающие в этом направлении в МГУ, Институте молекулярной генетики РАН, Институте цитологии РАН в Санкт-Петербурге, Петербургском институте ядерной физики.
Репарация ДНК не ограничивается теми путями, которые описаны в этой заметке. Есть еще и рекомбинационная репарация (Homologous recombination), когда для восстановления правильной последовательности ДНК используется ее копия с другой хромосомы, и воссоединение негомологичных концов(Microhomology-mediated end joining), когда часть ДНК теряется, но это часто неважно, потому что она приходится на некодирующие области. Оба этих вида репарации используются, когда нужно исправить двуцепочечный разрыв ДНК. Есть системы толерантности к повреждению (Translesion synthesis), когда клетка может функционировать и даже делиться, несмотря на то, что с ее геномом не всё в порядке. Есть клеточные системы ответа на повреждение(DNA damage response), которые определяют, что клетке делать, если ее ДНК повреждена, — делиться, остановить деление и попытаться отрепарировать повреждение, умереть... Кстати, за исследование последней системы в этом году американцы Стефан Эллидж (Stephen Elledge) и Эвелин Виткин (Evelyn M. Witkin) получили Ласкеровскую премию (Lasker Award) — вторую по престижности в биомедицине; зачастую она служит «предвестником» Нобелевской. Но 94-летняя Эвелин Виткин, которая открыла первую систему координированного клеточного ответа на повреждение ДНК — SOS-ответ — заветной медали вряд ли дождется. Зря Нобель завещал делить премию не более чем на троих; достойных кандидатов гораздо больше.
Источники:
1) Tomas Lindahl. New class of enzymes acting on damaged DNA // Nature. 1976. V. 259. P. 64–66.
2) Tomas Lindahl. Instability and decay of the primary structure of DNA // Nature. 1993. V. 362. P. 709–715.
3) A.-Lien Lu, Susanna Clark, and Paul Modrich. Methyl-directed repair of DNA base pair mismatches in vitro // Proc. Natl Acad. Sci. USA. 1983. V. 80. P. 4639–4643.
4) Paul Modrich. Mechanisms and biological effects of mismatch repair // Annu. Rev. Genet. 1991. V. 25. P. 229–253.
5) Aziz Sancar, W. Dean Rupp. A novel repair enzyme: UVRABC excision nuclease of Escherichia coli cuts a DNA strand on both sides of the damaged region // Cell. 1983. V. 33. P. 249–260.
6) Aziz Sancar. Structure and function of DNA photolyase // Biochemistry. 1994. V. 33. P. 2–9.
Дмитрий Жарков
ионная репарация с помощью белков комплекса uvrABC