Классификация каталитических доменов
Классификация целлюлаз по структурным признакам каталитических доменов (КД), была введена в начале 90-х г. на основе анализа распределения гидрофобных кластеров по полипептидной цепи и легла в основу общей структурной классификации гликозилгидролаз
Ферменты целлюлолитической системы сгруппированы в следующие семейства: 5/А; б/В; 7/С; 8/D; 9/Е; 10/F; 11/G; 12/Н; 26/1; 44/J; 45/K; 48/L; 51, 60 и 61, три из которых - 5/А, 9/Е и 45/К - дополнительно разделены на подсемейства. Буквенные обозначения, указанные через дробь, соответствуют раннему варианту номенклатуры, введенному в 1991г. Главная ценность структурной классификации состоит в том, что она предсказывает свойства белка, если установлено его семейство; служит основой для направленного мутагенеза; позволяет раскрывать взаимосвязи между явлениями и объектами. Так, в структурной классификации имеются семейства, включающие целлобиогидролазы грибного (7/С), бактериального (48/ L) происхождения, а так же те и другие (б/В). Это свидетельствует, во-первых о существовании специфических грибных и бактериальных механизмов разложения целлюлозы и, во-вторых, показывает возможность горизонтального переноса генетического материала между отдаленными хозяевами.
Разложение полиморфной нативной целлюлозы до простых сахаров требует совместного действия ферментов разных типов. Только целлобиогидролаз в превращении целлюлозы участвует не менее двух. Целлобиогидролазы (СВН) можно встретить в 5 семействах: 6/В, 7/С, 9/Е(1), 10/F и 48/L. Грибные целлобиогидролазы принадлежат к семействам 6/В и 7/С, бактерий Сеllulomonas fimi - к семействам 6/В, 10/F и 48/L, а клостридий - к семействам 9/Е(1) и 48/L.
Наличие близких типов укладки полипептидной цепи и локализации функциональных групп у ферментов разных семейств способствовало их объединению в суперсемейства или кланы. Среди гликозилгидролаз (GH) выделено пять таких кланов: GH-A (семейства 1, 2, 5, 10, 17, 26, 30, 35, 39, 42, 51, 53), GH-B (семейства 7 и 16), GH-C (семейства 11 и 12), GH-D (семейства 27 и 36) и GH-E (семейства 33 и 34).
Анализ укладки каталитических доменов целлюлаз различных семейств свидетельствует, что большинство из них относится к таким известным типам укладки сходными с триозофосфатизомеразной структурой (ТИМ-бочка или (β/α)8-бочка) иммуноглобулиноподобного "блинчика с джемом", лектиноподобного β-сэндвича, а также (α,α)6-бочек различных размеров.
ТИМ-бочка с активным центром, локализованным на С-конце, является весьма распространенным каркасом для гликозилгидролаз. Третичная структура КД целлобиогидролазы СВН II Trichoderma reesei родственна ТИМ-бочке с той разницей, что число α-спиралей и β-тяжей составляет пять и семь и поэтой причине является незавершенной или недостроенной ТИМ-бочкой. Полноразмерная или незавершенная ТИМ {(β/α)8}-бочка, встречающаяся у ферментов семейств 1, 2, 3, 5/А, 6/В, 10/F, 17, 26/I, 30, 35, 39, 42, 51 и 53.
Полипептидная цепь КД СеlC - целлюлазы мезофильной клостридии (семейство 8/D) свернута в (α,α)6-бочку из 365 аминокислотных остатков. Структура КД эндоглюканазы D термофильной клостридии тоже представляет собой (α,α)6-бочку - правозакрученную тороидальную структуру из шести почти параллельных внутренних α-спиралей, которые окруженны шестью внешними α-спиралями, идущими в противоположном направлении. На С-конце внутренних спиралей три длинные соединительные петли, содержащие короткие α-спирали, формируют активный центр. Общая длина полипептидной цепи, составляющей эту часть, составляет около 450 остатков. У эндоглюканазы D с N-конца жестко прикреплен меньший по размерам иммуноглобулиноподобный домен из 90 аминокислотных остатков, уложенных в восемь β-тяжей. Этот элемент структуры сходен с частями антител. Такой тип укладки называется "блинчик с джемом" и содержит гидрофобное ядро, полностью состоящее из неполярных ароматических и алифатических остатков. Подобные фрагменты встречаются в каталитической части и некоторых других представителей семейства 9/Е, например, у фермента Е4 термофильного актиномицета и представляют собой ЦСД, ассоциированные с КД. Они жестко связаны с (α,α)6-бочкой собственно каталитической части фермента так, что вход в активный центр является продолжением ЦСД и связываемая им целлюлозная молекула напрямую ориентируется в активный центр. По этой причине последовательность этих ЦСД часто включают в последовательность КД семейства 9/Е2.
Топология (α,α)6-бочки свойственна ферментам семейств 8/D, 9/Е и 48/L, хотя они сильно отличаются размером.
Структура КД грибной СВН I представляет собой искаженный β-сэндвич с вогнутой и выпуклой сторонами, состоящими, соответственно, из семи и восьми антипараллельных β-тяжей, соединенных в отдельных местах короткими α-спиральными участками . У целлобиогидролазы I КД содержит 434 остатка и имеет размеры 40х50х60 Å.
Ферменты семейств 11/G и 12/Н имеют топологию укладки КД по типу "грудной клетки". Укладка КД грибных ферментов семейства 7/С характеризуется как β-сэндвич типа конканавалина А. Эта топология свойственна бактериальным лихеназам (семейство 16). Структура КД семейств 7, 11, 12 и 16 относится к общей категории 12-14-тяжевых β-сэндвичей.
Структура типа "закрытая" 6-β-бочка семейства 45/К, является примером редкого типа укладки, которая возможна у других гликозилгидролаз (хитиназ) и в определенном отношении сходна со структурой иммуноглобулиноподобных ЦСД.
Классификация субстратсвязывающих доменов
Целлюлозосвязывающий домен (ЦСД) – важный элемент белковой структуры, участвующей в процессе превращения целлюлозы.
ЦСД различных семейств значительно отличаются длиной полипептидной цепи. У грибов ЦСД в три - семь раз короче бактериальных ЦСД семейств II, III, IY, YI, YII, IX. Изученные ЦСД бактерий почти не уступают по размерам небольшим КД ряда гликозилгидролаз семейств 11/G, 12/H или 45/К. Для ЦСД семейств II, III, IY характерна сходная с семейством 45/К укладка β-тяжей типа иммуноглобулиновой или "блинчика с джемом" ( табл.6).
Таблица 6
Классификация целлюлозосвязывающих доменов (по Tomme et al., 1995)
| Сeмейство | Организм | Фермент | Положение* | Количество аминокислотныхостатков** | Укладка | Cемейство каталитиче ского домена | Источ-ник*** |
| I | Agaricus bisporus | Cel1 | C | Клиновид-ная, трехтяжевый антипараллельный β-лист | M86356 | ||
| Fusarium oxysporum | Xyn | N | 10/F | L29380 | |||
| Neocallimastix patriciarum | XylB | C | 10/F | S71569 | |||
| Humicola insolens | EGY | C | 45/K | [Schou et al., 1993] | |||
| Neurospora crassa | CBHI CBHI CBHI | C | 7/C | X7778 | |||
| Penicillium janthinellum | X59054 | ||||||
| Phanerochaete chrysosporium | M22220 | ||||||
| Porphyra purpurea | PBP | X4 | Негидролитический белок | U08843 | |||
| Trichoderma reesei | CBHI CBHII EGI EGII EGY Man | C N C N C C | 7/C 6/B 7/C 5/A5 45/K 5/A1 | P00725 M16190 M15665 M19373 Z33381 L25310 | |||
| IIa | Butirivibrio fibrisolvens | End1 | C | Десять антипарал-лельных β-тяжей, девять образуют β-бочку | 5/A4 | X17538 | |
| Cellulomonas fimi | CenA CenB CenD CbhA CbhB Cex | N C C C C C | 6/B 9/E2 5/A1 6/B 48/L 10/F | M15823 M64644 L02544 L25809 L29042 L11080 | |||
| Clostridium cellulovorans | EngD | C | 5/A4 | M37434 | |||
| Dictiostelium discoideum | SGSP | C,I | 98/106 | (синтезируется при прора- стании спор) | M33861 | ||
| Microbispora bispora | CelA | C | 6/B | P26414 | |||
| Pseudomonas fluorescens | CelA CelB CelC CelE XynA | C N N C N | 9/E1 45/K 5/A1 5/A2 10/F | X12570 X52615 X61299 X86798 X15429 | |||
| Streptomyces lividans | CelA CelB ChiC | N C N | 5/A2 12/H 18 (Хитиназы) | M82807 U04629 D12647 | |||
| Thermomonspora fusca | E2 E3 E5 | C N N | 6/C 6/C 5/A2 | M73321 U18978 L01577 | |||
| IIb | Cellulomonas fimi | XynD | X2C | 11/G | X76729 | ||
| Streptomyces lividans | Axe | C | Ацетилксилан-эстераза | [Tomme et al., 1995,б] | |||
| Thermomonospora fusca | XynA | C | скрученный b-сэндвич | 11/G | U01242 | ||
| IIIa | Bacillus lautus | CelA | C | Девяти-тяжевый β-сэндвич, связывающий Са2+ | 44/J | M76588 | |
| Bacillus subtilis | Cel | C | 5/A2 | X67044 | |||
| Caldicellulosiruptor (Caldocellum) saccharolyticum | CelA CelB CelC ManA | x2I I x2I x2I | 9/E2//48/L 10/F//5/A1 9/E2//5/A4 5/A4//44/J | L32742 X13602 [] L01257 | |||
| Clostridium cellulovorans | CbpA | N | Скаффолдин | M73817 | |||
| Clostridium stercorarium | CelZ | C | 9/E2 | X55299 | |||
| Clostridium thermocellum | Cbh3 CipA CelI | C I C | 9/E1 Скаффолдин 9/E2 | X80993 L08665 L04735 | |||
| Erwinia carotovora | CelY | C | 9/E2 | X76000 | |||
| IIIb | Cellulomonas fimi | CenB | I | 9/E2 | M64644 X55299 L04735 | ||
| Clostridium stercorarium | CelZ | ||||||
| Clostridium thermocellum | CelI | ||||||
| IY | Cellulomonas fimi | CenC | x2N | "Блинчик с джемом" из двух β-листов по пять тяжей (м.б. 5 и 6 тяжей) | 9/E1 | X57858 | |
| Clostridium cellulolyticum | CelE | N | M87018 | ||||
| Streptomyces reticuli | Cel1 | L04735 | |||||
| Thermomonospora fusca | E1 | L20094 | |||||
| Myxococcus xantus | CelA | 6/B | X76726 | ||||
| Y | Erwinia chrysanthemi | EgZ | C | «лыжный ботинок», b-лист из трех антипараллельных b-тяжей, перпендикулярный неупорядоченной петле | 5/A2 | Y00540 | |
| YI | Bacillus polymyxa | XynD | C | X57094 | |||
| Clostridium stercorarium | XynA | X2C | 87/92 | 11/G | D13325 | ||
| Clostridium thermocellum | XynZ | I | 10/F | M22624 | |||
| Краб-подкова | G-α | X2C | 16 (Фактор коагуляции) | D16623 | |||
| Microbispora bispora | BglA | C | L06134 | ||||
| YII | Clostridium thermocellum | CelE | I | 5/A4 | M22759 | ||
| YIII | Dictiostelium discoideum | CelA | N | 9/E2 | M33861 | ||
| IX | Clostridium thermocellum | XynX | X2C | 174/189 | 10/F | M67438 | |
| Thermoanaerobacterium sp. | XynA | 174/187 | M97882 | ||||
| Thermotoga maritima | XynA | 170/180 | Z46264 | ||||
| X | Cellvibrio mixtus | XynA | C | Два b-листа из 2-х и 3-х антипараллельных тяжей, a-спираль поперек большего листа. | 11/G | Z48925 | |
| Pseudomonas fluorescens | CelA CelB CelC CelE XynA XynE | I | 9/A1 45/K 5/A1 5/A2 10/F 11/G | X12570 X52615 X61299 X86798 X15428 Z48927 | |||
| C |
* Указана локализация ЦСД на С, N-конце или в середине (I) молекулы белка; х4 или х2 означает число повторов ЦСД; ** Длина аминокислотных последовательностей ЦСД приведена ориентировочно; ***В качестве источника аминокислотных последовательностей указаны их номера в базах данных SWISS-PROT, EMBL/GenBank, PIR и ссылки на соответствующие публикации
Центры связывания ЦСД, как правило, плоские или слегка вогнутые в отличие от туннелей, щелей КД. Кроме того, ароматические остатки tyr, trp, выполняющие важную роль во взаимодействии с углеводами, обращены наружу. Это позволяет ЦСД одновременно взаимодействовать с несколькими соседними молекулами полисахарида на поверхности и обеспечивать необходимую прочность связывания. Локализация ЦСД на С-, N- конце или в середине белковой молекулы, присутствие в одной молекуле нескольких ЦСД, наличие негидролитических белков, состоящих из повторяющихся ЦСД свидетельствует об их самостоятельной функции в процессе деструкции целлюлозы. Считается, что сорбционный домен не может связываться с короткими олигосахаридами.
ЦСД различных семейств отличаются принадлежностью к различным организмам и проявляют разную специфичность. Так ЦСД грибов семейств I и II способны адсорбироваться на целлюлозе, но не связываются с хитином. Очевидно, грибы и другие эукариоты могут иметь специализированные домены, отвечающие за сорбцию ферментов на хитине клеточных стенок, сходные с хитинсвязывающими ЦСД бактериальных семейств.
Домены семейства IIb проявляют различия в специфичности сорбции. Из них одна часть связывается только с ксиланом, другая - и с целлюлозой, и с ксиланом. В этом случае было бы правильнее называть их ксилансвязывающими доменами, так как сорбция на целлюлозе является побочной функцией. Считают, что различия в специфичности сорбции у представителей семейства II могут быть обусловлены широкими вариациями общего заряда глобулы и его поверхностного распределения.
Относительно крупные ЦСД аэробных и анаэробных бактерий с длиной полипептидной цепи от 131 до 172 остатков объединены в семейство III, которое состоит из двух подгрупп. Основная подгруппа IIIa объединяет ЦСД скаффолдинов и ЦСД целлюлаз, каталитические домены, которых относятся к семействам 5/А1,2,4; 9/Е1,2; 10/F; 44/J; 48/L. ЦСД в большинстве своем располагаются на С-конце белка, однако у ферментов бактерии Caldicellulosiruptor (Caldocellum) saccharolyticum, совмещающих в одной структуре два КД гликозилгидролаз разных семейств, они могут располагаться и в середине. У клостридий ЦСД тоже могут располагаться в середине или на N-конце молекулы. ЦСД подсемейства IIIb встречаются только в центральной части молекулы, в сочетании с КД семейства 9/Е2, причем могут соседствовать с ЦСД семейства IIa и обеспечивают слабое связывание с целлюлозой.
В семейство IY входят ЦСД анаэробных, аэробных бактерий и актиномицетов. Они обнаружены только на N-конце молекул ферментов, в том числе в виде повтора, в сочетании с КД семейств 9/Е1, 6/В и 10/F. Некоторых из них обладают способностью к связыванию с аморфной, набухшей в фосфорной кислоте целлюлозой.
ЦСД эндоглюканазы Z грам-отрицательной бактерии E. сhrysantemi является представителем семейства Y. Он расположен на С-конце фермента, каталитический домен которого принадлежит к семейству 5/А2 и состоит из 63 остатков. Подобно ЦСД грибов, он имеет плоскую поверхность, на которой расположены два остатка триптофана и один тирозин, которые, очевидно ответственны за связывание с целлюлозой.
Семейство YI включает ЦСД β-глюкозидазы А актиномицета и клостридиальных ксиланаз семейств 10/F и 11/G, а также дуплицированный домен в специфичном к 1,3-β-глюкану факторе коагуляции G-α из гемолимфы краба-подковы. ЦСД этой группы расположены либо на С-конце, либо в середине полипептидной цепи и могут встречаться в виде повтора.
Для представителей семейства YII и YIII установлена способность к связыванию с целлюлозой. К ним относятся: эндоглюканаза Е (семейство 5/А4 КД) из клостридий, имеющая наибольшую среди всех ЦСД длину - 240 аминокислотных остатков и находящаяся внутри полипептидной цепи фермента, а так же целлюлазы А слизевика (семейство 9/Е2), у которых ЦСД аналогичен по размерам ЦСД семейств III и IY (152 остатка) и прикреплен с N-конца. У представителей семейства IX ЦСД обнаружены в виде повтора на С-концах некоторых термостабильных ксиланаз трех типов термофильных анаэробных бактерий, КД которых принадлежат к семейству 10/F. Они представляют большие домены состоящие из 170-189 остатков. Небольшие ЦСД из 51-55 остатков, найденные на С-концах или в центральной части полипептидной цепи у ферментов бактерий преимущественно из рода псевдомонад, КД которых принадлежат к семействам 5/А1,2; 9/Е1, 10/F, 11/G и 45/К, относятся к семейству Х. Новые типы ЦСД, обнаруженные за последние годы выделены в семейства XI и XII Внутри перечисленных семейств ЦСД наблюдаются различия в способности к сорбции на 1,4-β-гликанах: целлюлозе, ксилане, хитине и значительно более сильное взаимодействие с нерастворимыми полисахаридами в сравнении с их растворимыми олигомерами. Центры их связывания, как правило, плоские или слегка вогнутые, в отличие от глубоких ложбин или туннелей КД гликозилгидролаз. В отличие от КД ароматические остатки Trp и Tyr, выполняющие важную роль во взаимодействии с углеводами, экспонированы у них наружу и поэтому ЦСД способны одновременно взаимодействовать с несколькими соседними молекулами полисахарида на поверхности. ЦСД на поверхности, возможно, взаимодействуют с отдельными функциональными группами не с глюкозных звеньев соседних цепей, и благодаря этому обеспечивают необходимую прочность связывания. Кроме того, ЦСД, вероятно, не имеют барьерных сайтов, искажающих конфигурацию глюкозного остатка и этим затрудняющих его связывание. Это также отличает их от КД, использующих механизм сорбции с искажением субстрата для повышения эффективности катализа.
Молекулярные механизмы действия целлюлаз
Современные представления о молекулярных процессах, обусловливающих ферментативный гидролиз целлюлозы, еще недостаточно полны. Это связано с тем, что целлюлоза является субстратом со сложной надмолекулярной структурой, которую трудно охарактеризовать даже с помощью большого набора физико-химических параметров, таких, как размер частиц, степень полимеризации, степень кристалличности и т.д. С другой стороны, целлюлазный комплекс имеет довольно сложную структуру. В него входит много ферментов, различающихся как продуктами реакции, так и молекулярными характеристиками (молекулярной массой, аминокислотным составом и последовательностью, способностью адсорбироваться на целлюлозе, каталитической активностью и т.д.). Кроме того, целлюлазы почти из любого организма найдены в виде целого ряда изоферментов.
Одна из моделей активного центра карбогидраз (в том числе целлюлаз и гемицеллюлаз) представляет его структуру в виде последовательности участков (сайтов), каждый из которых вмещает по одному углеводному остатку полимерного субстрата. Все субсайты имеют разное сродство к моносахаридному остатку, причем субсайт, непосредственно предшествующий каталитическому центру препятствует сорбции глюкопиранозного остатка и называется барьерным. Сорбция на этом субсайте сопровождается искажением структуры как фермента так и субстрата и происходит лишь за счет связывания соседних углеводных остатков с субсайтами, обладающими высоким сродством к субстрату.
Каталитический центр, в котором происходит расщепление гликозидной связи, делит активный центр на гликоновую часть, где происходит высвобождение продукта реакции, и агликоновую, со стороны которой полисахарид проникает в активный центр. Так, активный центр экзогидролаз имеет высокий барьерный сайт, блокирующий продвижение невосстанавливающего конца субстрата вглубь фермента, а количество связывающих сайтов гликоновой части активного центра определяет длину отщепляемого продукта (1 - для глюкогидролаз, 2 - для целлобиогидролаз и т.д.). После местоположения расщепляемой связи следуют несколько связывающих сайтов агликоновой части.
У олигосахаридгидролаз, специфичных к коротким олигосахаридам и не действующих на полисахариды, высокие барьерные сайты должны ограничивать как гликоновый, так и агликоновый участки активного центра. Например, у целлобиаз, наилучшим субстратом которых является дисахарид, гликоновая часть, ограниченная барьерным сайтом, содержит один связывающий сайт, а агликоновая один или несколько слабо связывающих или барьерных сайтов, которые и определяют более слабое действие фермента на три- и тетрасахариды. Агликоновую часть ограничивает высокий барьерный сайт, препятствующий действию целлобиаз на полимерный субстрат.
Активный центр эндоглюканаз не ограничен ни в гликоновой, ни в агликоновой части. Однако в нем присутствуют барьерные сайты непосредственно вблизи положения расщепляемой связи и/или на краю активного центра, определяющие более высокую специфичность фермента по отношению к одному из концов полимера. Длина активного центра эндоглюканаз варьирует от четырех до двенадцати моносахаридных остатков (рис.30).
С применением современных методов исследования, таких, как рентгеноструктурный анализ, доказана справедливость субсайтной модели для большинства целлюлаз. Так, целлобиогидролазы I и II из дейтеромицета Trichoderma reesei из длинных полипептидных цепей формируют на поверхности фермента тоннель активного центра. Гликоновая цепь из нескольких глюкозных единиц может быть связана гидрофобными связями с триптофановыми остатками, выстилающими внутренние стенки тоннеля.
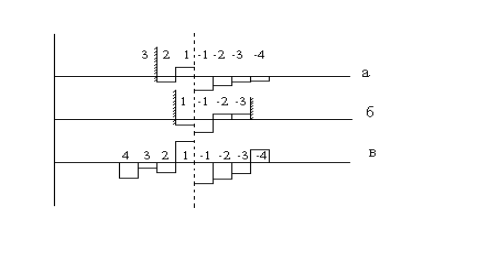
Рис. 30.Условные гистограммы показателей сродства субсайтов в активных центрах карбогидраз различных типов: а - экзофермент, отщепляющий дисахарид от невосстанавливающего конца молекулы субстрата; б - олигосахаридгидролаза, специфичная к дисахариду и не действующая на полимеры; в - эндоглюканаза, специфичная к восстанавливающему концу полисахарида.
Целлобиогидролаза I, относящаяся к семейству 7, образует тоннель длиной 50 А и имеет 10 гликозил связанных субсайтов - от -7 до +3. Все субсайты расположены внутри тоннеля, за исключением -7, который направляет полисахарид в активный центр. Целлюлозная цепь, продвигаясь по тоннелю, скручивается примерно на 180о, что усиливает деформацию напряжения и способствует разрыву связи, приэтом свободное вращение остатков глюкозы там невозможно. Предполагаемый механизм катализа включает связывание целлононамера на субсайтах от -7 до +2, образование целлобиозы на аглюконовых участках +1 и +2 и карбокатиона гептамера на субсайтах от -7 до -1, его ковалентное связывание с остатком E212, гидролиз гликозилфермента и десорбцию продуктов.
Подобным же образом устроена молекула целлобиогидролазы II (СВН ΙΙ). Активный центр образован двумя устойчивыми поверхностными петлями на жесткой структуре незавершенной ТИМ – бочки и имеет форму более короткого туннеля, нежели у СВН Ι. Тоннель содержит 4 связывающих сайта (-2, -1, +1, +2) для сахарных единиц. Так же имеется дополнительный, связывающий сайт +4 для шестого гликозильного остатка у входа в тоннель. В сайтах -2, +1, +2 и +4 сахара связаны гидрофобными связями с Trp135 (-2), Trp269 (+1), Trp367 (+2) и Trp272 (+4). Данный фермент содержит N-концевой ЦСД семейства 1.
Эндоглюканаза I из T. reesei на 45% идентична целлобиогидролазе I. Однако, тоннель образующая петля намного короче или вообще отсутствует, поэтому формируется не тоннель, а желоб.
После того, как, благодаря субсайтному взаимодействию, полисахаридная цепь соответствующим образом ориентирована в активном центре фермента, происходит непосредственно гидролиз О-гликозидной связи. По современным представлениям в активном центре карбогидраз осуществляется кислотно-основной катализ, при котором функциональные группы выступают как доноры или акцепторы протонов (кислоты и основания Бренстеда).
В зависимости от того, сохраняется или обращается конфигурация аномерного гидроксила при разрыве β-1.4-гликозидной связи, возможны два механизма гидролиза.
Механизм, протекающий с сохранением β-конфигурации, выглядит следующим образом. Протондонорная группа атакует гликозидазный кислород, а отрицательно заряженная группа способствует гидролизу гликозидной части и стабилизирует карбоний аксониевый катион, в котором положительный заряд на С-1 атоме частично перераспределяется на кислород пиранозного кольца. Образуется тесная ионная пара, ориентированная в активном центре таким образом, что доступ молекулы воды возможен только со стороны уходящей группы. После десорбции агликона, со стороны уходящего остатка атом С-1 атакуется водой, ориентируемой депротонированной группой фермента А. В результате происходит сохранение β-конфигурации у продукта реакции, десорбирующегося последним из гликоновой части (рис.31).
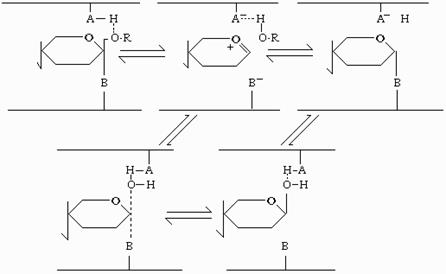
Рис. 31.Механизм гидролиза целлюлозы, протекающий с сохранением конфигурации аномерного гидроксила у продукта реакции. АН - каталитическая группа фермента, осуществляющая общий кислотный катализ путем протонирования гликозидазного кислорода (например, СООН - группа Асп или Глу); В - каталитическая группа фермента, осуществляющая синхронно общий основной или нуклеофильный катализ и атакующая С-1 (карбоксилат анион Асп); R - фрагмент субстрата, локализующийся на агликоновых субсайтах
Важным моментом в каталитическом акте является искажение конформации "кресла" пиранозного кольца в конформацию "полукресла". Как отмечалось выше, барьерный субсайт не обладает высоким сродством к конформации "кресла". Однако он обладает высоким сродством к конформации полукресла, реализуемой в переходном состоянии. Таким образом, этот субсайт выполняет функцию стабилизации переходного состояния в активном центре фермента.
Для ферментативного катализа, протекающего с обращением конфигурации аномерного гидроксила у продуктов реакции в β -форму, предложен другой механизм. В этом случае С-1 атом атакуется не нуклеофильной группой фермента, а молекулой воды, координируемой в активном центре, нуклеофильность которой повышается благодаря взаимодействию с основной группой активного центра. Десорбция гликона должна происходить первой, после чего на его место диффундирует молекула воды, и лишь затем возможна десорбция агликона (рис. 32).
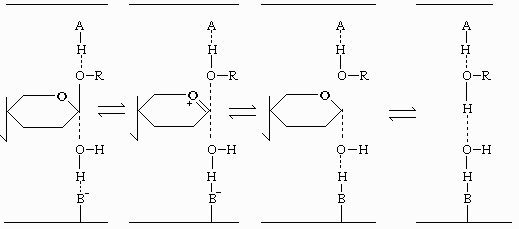
Рис.32. Механизм гидролиза целлюлозы, протекающий с обращением конфигурации аномерного гидроксила у продуктов реакции
Так, у целлобиогидролазы II из Trichoderma reesei в разрыв связи, осуществляемой между сайтами -1 и +1 вовлечены, как минимум, два смежных остатка аспарагиновой кислоты 175 и 221. По-видимому, главная роль принадлежит Asp221, который выполняет протонакцепторную функцию и вместе с Tyr169, расположенным в сайте -1, осуществляет каталитический акт.
Большие сложности в изучение действия целлюлаз вносит наличие синергизма между различными компонентами целлюлазного комплекса при действии на нерастворимую целлюлозу. Действие на целлюлозу, по крайней мере, двух целлюлолитических компонентов приводит к более эффективной деградации субстрата, чем сумма действий этих компонентов по отдельности (явление синергизма было впервые описано в начале 60-х годов).
В целлюлазном комплексе синергизм осуществляется следующим образом. Эндоглюканазы расщепляют связи, удаленные от концов полимерной цепи и приводят к уменьшению степени полимеризации молекулы целлюлозы. Глюкоза и олигосахариды тоже могут являться продуктами действия эндоглюканаз. Целлобиогидролаза отщепляет целлобиозу от невосстанавливающего конца целлюлозы. Экзоглюканаза атакует целлюлозу или частично гидролизованную целлюлозу с образованием глюкозы. Наконец, целлобиаза гидролизует целлобиозу до глюкозы (рис.33 ).
Некоторые эндоглюканазы способны по механизму трансгликозилирования осуществлять гидролиз целлобиозы до глюкозы в присутствии целлюлозы. При этом фермент отщепляет от молекулы целлобиозы молекулу глюкозы и присоединяет ее к целлюлозе или целлоолигосахаридам, а другая молекула глюкозы остается в растворе. Такой “нецеллобиазный” путь образования глюкозы может играть важную роль в ферментативном гидролизе целлюлозы.
Так, целлюлазный комплекс из Trichoderma reesei образует достаточно много глюкозы из целлюлозы, хотя практически не содержит целлобиаз, которые могут дать лишь 2-8% от общего количества образуемой глюкозы. В то же время целлюлазный комплекс из Aspergillus niger образует глюкозу практически исключительно за счет своей целлобиазы.
экзоглюкозидаза и/или эндоглюканаза



эндоглюканаза целлобиогидролаза целлобиаза


 Gn Gn/x G2 G
Gn Gn/x G2 G

 эндоглюканаза и/или целлобиогидролаза
эндоглюканаза и/или целлобиогидролаза
 |
Рис.33. Общая схема ферментативного гидролиза целлюлозы
Gn - исходная целлюлоза; Gn/x- нерастворимые продукты неупорядоченного гидролиза целлюлозы cо значением степени полимеризации меньшим, чем у исходной целлюлозы; G2 - целлобиоза; G – глюкоза
Однако такой молекулярный механизм синергизма не может объяснить, почему далеко не все эндоглюканазы и целлобиогидролазы принимают в нем участие - очень часто между эндоглюканазой из одного источника и целлобиогидролазой из другого или между целлобиогидролазой и разными эндоглюканазами из одного источника синергизм не наблюдается.
Кроме этого, при гидролизе нерастворимой кристаллической целлюлозы неоднократно наблюдали синергизм между двумя целлобиогидролазами и двумя эндоглюканазами. Было показано, что максимальная степень гидролиза древесины ивы, предобработанной паровым взрывом при синергическом взаимодействии эндоглюканазы II и целлобиогидролазы I была достигнута при соотношении EGII/CBHI равному 5/95. Та же самая конверсия достигнута при соотношении 40/60, что так же нельзя объяснить в рамках последовательного механизма действия эндо- и экзоферментов.
Частично эти противоречия снимаются при исследовании сорбционных свойств целлюлолитических ферментов: большинство целлюлаз помимо обычного активного центра, имеют так называемый сорбционный центр, который обеспечивает избирательное связывание фермента с нерастворимым субстратом и не проявляется при действии фермента на нерастворимые полисахариды.
С помощью малоуглового рентгеновского рассеяния было установлено, что молекула типичной целлобиогидролазы I (СВН Ι) из Trichoderma reesei имеет в растворе форму «головастика», в котором «голова» имеет размер 4х4 нм, а «хвост» длиной 18 нм (рис.34). Такую же структуру имеют эндоглюканаза из гриба Sporotrichum pulverulentum и две эндоглюканазы бактерии Сellulomonas fimi.
Активный центр (СВН Ι) Trichoderma reesei представляет туннель вдоль вогнутой части β- сэндвича, перекрытый сверху гибкими петлями, сшитыми девятью SS- мостиками. У (СВН Ι) имеется С-концевой целлюлозосвязывающий домен необходимый для разложения упорядоченной целлюлозы. Он состоит из 38 аминокислотных остатка, образующих клиновидную структуру с искаженным β-листом из трех коротких антипараллельных тяжей в основании , выраженными гидрофильной и гидрофобной плоскостями и стабилизированная двумя SS-связями. На гидрофильной стороне имеется четыре высококонсервативных ароматических остатка, из которых не менее трех участвуют в связывании с целлюлозой. Относительно легкая десорбция ЦСД с нативной целлюлозы позволяет перемещаться каталитическому домену вдоль полимерной цепи при последовательном отщеплении целлобиозы.
Кроме обеспечения контакта между ферментом и субстратом, адсорбция целлюлаз на целлюлозе играет определяющую роль в эффективном гидролизе целлюлозы, в первую очередь кристаллической. По современным представлениям, скорость ферментативного гидролиза кристаллической целлюлозы определяется правилом "лучше адсорбция - лучше гидролиз".

Рис. 34.Молекула двудоменных целлюлаз (на примере целлобиогидролазы I из целлюлазного комплекса Trichoderma reesei): (А) - Схематическое изображение гена, кодирующего фермент. Показано количество пар нуклеотидов, отвечающих за функциональные области фермента; (В) - Общая схема молекулы фермента; (С) - Схематически показано гликозилирование переходной области фермента; CCD - каталитический домен; LR - переходная (линкерная) последовательность; СBD - целлюлозосвязывающий домен
Целлюлазные комплексы из различных природных источников условно разделяют на "полноценные" и "неполноценные". Первые действуют как на аморфную, так и на кристаллическую целлюлозу, в то время как другие действуют лишь на аморфную целлюлозу и не эффективны по отношению к целлюлозе кристаллической.
Многочисленные данные показывают, чем выше кристалличность целлюлозы, тем она труднее гидролизуется слабо адсорбирующимися ферментами, но хорошо гидролизуется прочно адсорбирующимися ферментами при той же их концентрации. Если для гидролиза аморфной целлюлозы важна только активность используемого ферментного препарата, то для гидролиза кристаллической целлюлозы более важным является способность целлюлаз адсорбироваться на поверхности субстрата. Это связано с механохимическим действием целлюлаз на кристаллическую целлюлозу: первой стадией ферментативной деградации микрофибрилл целлюлозы является их расслаивание вдоль продольной оси с образованием более тонких субфибрилл.
Предлагалось несколько механизмов ферментативного гидролиза кристаллической целлюлозы: наличие С1- фермента, не гидролитического типа ; наличие эндоглюканазы упорядоченного действия - авицелазы; совместное действие ферментов эндо- и экзотипа – кинетический синергизм; наличие особой эндоглюканазы, действующей только на кристаллическую целлюлозу;образование комплекса между эндоглюканазой и целлобиогидролазой на поверхности кристаллической целлюлозы. Наиболее перспективен механизм, обьясняющий гидролиз механохимическим действием целлюлаз на кристаллическую целлюлозу.
Явление диспергирования целлюлозы под действием целлюлаз было обнаружено в 60-х годах. Диспергирование может быть результатом как гидролитических, так и механических воздействий на целлюлозу. При гидролитическом диспергировании происходит ферментативное расщепление макромолекул целлюлозы, связывающих отдельные микрофибриллы. Механическое диспергирование происходит за счет адсорбции ферментов в дефектах и проникновение их в межфибриллярное пространство. При этом в дефектах поверхности субстрата происходит концентрирование фермента и, как следствие, повышается механическое воздействие на стенки капилляров, пор, микротрещин целлюлозы. Имеющаяся в порах вода проникает дальше вглубь капилляров, разрывая водородные связи между молекулами целлюлозы, расслаивая микрокристаллы и сольватируя их, а адсорбированные целлюлазы стабилизируют образовавшиеся разломы против слипания. Прочно адсорбирующиеся целлюлазы вызывают механическое диспергирование частиц целлюлозы. Скорость ферментативного гидролиза кристаллической целлюлозы определяется правилом "лучше адсорбция - лучше гидролиз"
Однако правило "лучше адсорбция - лучше гидролиз" не является абсолютным и строго соблюдается либо для неразделенных целлюлазных комплексов, либо для индивидуальных эндоглюканаз из одного микроорганизма. Исключения из этого правила касаются гомогенных эндоглюканаз из различных источников, которые могут значительно различаться по способности катализировать реакции трансгликозилирования с образованием глюкозы, и это свойство может иметь для эффективной деградации кристаллической целлюлозы значение не меньшее, чем адсорбционная способность фермента.
Присутствие в целлюлазной системе ферментов с высоким и низким сродством к целлюлозе повышает эффективность гидролиза кристаллической целлюлозы, и, кроме "кинетического" синергизма, обусловленного совместным действием на субстрат ферментов экзо- и эндо- типа, целлюлазные комплексы могут проявлять "сорбционный" синергизм - прочносорбирующийся фермент, связываясь с целлюлозой в местах нарушения ее кристаллической структуры, вызывает диспергирование кристаллитов за счет соответствующих механохимических эффектов, проникая в области с неупорядоченной структурой. Тем самым прочносорбируемый фермент может открывать новые участки для действия слабосорбируемых компонентов, которые активно действуют на аморфные области целлюлозы, расположенные на периферии микрокристаллов или становящиеся доступными при диспергировании.
В случае синергизма между двумя эндоглюканазами один из ферментов прочно, а другой слабо сорбируется на субстрате, и скорость гидролиза микрокристаллической целлюлозы под их действием более чем в 15 раз выше, чем под действием только прочноадсорбирующихся целлюлаз.
Синергизм между целлобиогидролазами и эндоглюканазами, выделенными из различных источников, наблюдается только в том случае, если эндоглюканаза обладала способностью прочно адсорбироваться на субстрате. Целлобиогидролаза I из Trichoderma reesei более прочно связывается целлюлозой, чем целлобиогидролаза II из того же источника, что так же может быть причиной синергизма между ними.
Однако оба вида синергизма могут в значительной степени зависеть от условий проведения ферментативного гидролиза (концентрации целлюлозы, концентрации ферментов, соотношения этих концентраций и т.д.) и от скорости лимитирующей стадии ферментативного гидролиза целлюлозы. Если в последовательном процессе, где первой действует эндоглюканаза, а затем - целлобиогидролаза, скорость лимитирующей стадии является первой, то синергизма может и не быть.
С позиций современной мультидоменной структуры Рабиновичем и Мельником (2000), рассмотрен один из возможных механизмов деградации упорядоченной целлюлозы, грибной целлобиогидролазой Ι. Авторы считают, что собственно ферментативный гидролиз гликозидной связи не является лимитирующей стадией этого достаточно медленного процесса. Процесс сдерживается, вероятно, необходимой для действия ферментов гидратацией целлюлозных молекул, которая может проходить в несколько этапов. На начальном этапе, сорбция ЦСД приводит к повышению степени гидратации молекул поверхностного слоя, благодаря эффекту некаталитического диспергирования пучков микрофибрилл. Последующие стадии характеризуются согласованным действием структурных компонентов: ЦСД, КД и линкера. При этом наиболее, вероятным, представляется катерпиллерный катализ, при котором происходит последовательное образование ряда близких по энергетике промежуточных менее прочных комплексов фермента и нерастворимого субстрата по пути: ( ЦСД*** – КД) → (ЦСД** – КД*)→ (ЦСД* – КД** ) → ( ЦСД– КД***) → (ЦСД** – КД*) и т.д. Числом звездочек авторы условно обозначили прочность связывания домена с целлюлозой.
В результате процесса может осуществляться последовательный отрыв звеньев целлюлозной цепи от поверхности и перемещение вдоль нее КД целлобиогидролазы І. При этом длина и степень конформационной жесткости линкера препятствует одновременному оптимальному связыванию обоих доменов и служит для освобождения очередного звена цепи от водородных связей с матрицей.
Процесс, по мнению авторов, может происходить следующим образом. После быстрого связывания с поверхностью через ЦСД фермент образует первый тип комплекса с участием КД, который включает связывание гидрофобной плоскости ЦСД I с несколькими поверхностными молекулами целлюлозы и захват восстанавливающего конца одной из цепей субсайтами -7- -5 активного центра. Дальнейшее продвижение цепи можно, объяснить высоким сродством фермента к изолированной цепи субстрата в растворе при непродуктивном связывании ее на участках -5 - -2 активного центра. Этот тип непродуктивного комплекса с частично изолированным восстанавливающим концом цепи должен приводить к напряжениям в жесткой части междоменного линкера и нарушению связывания ЦСД. Упругость жесткой части линкера, препятствующая одновременной реализации наиболее оптимального связывания обоих доменов, может являться «приводом» для освобождения очередного звена цепи от водородных связей с матрицей. При ослаблении связи молекулы целлюлозы с поверхностью и ее дальнейшем продвижении на субсайты –1, +1 и +2, т.е. образовании продуктивного фермент-субстратного комплекса, связывание ЦСД ослабляется и он десорбируется. Гидролиз и десорбция целлобиозы из активного центра могут вновь приводить к образованию устойчивого непродуктивного комплекса с частичным связыванием обоих доменов на поверхности и напряженным положением линкера. С этого момента начинается новый каталитический цикл. Предложенный механизм катерпиллерного катализа не выходит за рамки гипотетического и требует глубокого анализа, в первую очередь с позиций эволюции фермент-субстратных взаимодействий, кинетики и термодинамики гетерофазной реакции.
Для повышения степени деградации растительных субстратов перспективно использование мультиэнзимных композиций, созданных на основе различных продуцентов, где ферменты из разных источников могут удачно дополнять друг друга, образуя высокосинергичный комплекс. Большой интерес в этом плане представляют молекулярно-биологические методы, которые могут использоваться как для создания новых ферментных комплексов, так и для модификации отдельных ферментов.
Особенности грибных и бактериальных целлюлолитических ферментных систем
Ферментные системы, участвующие в трансформации целлюлозы подробно изучены на примере ферментов грибов из родов Trichoderma, Penicillium, Fusarium, Humicola, Phanerochaete, Schizophillum и др. В ферментных системах грибов обнаружены десятки «целлюлолитических» белков, при этом большинство из них являются гомологами или множественными формами основных компонентов. Так в составе наиболее изученных целлюлазных комплексов T. reesei (longibrachiatum) и H. insolens две целлобиогидролазы (I и II, семейства 6/В и 7/С КД, соответственно) и пять эндоглюканаз: I (7/С); II (5/A5); III (12/Н), IY (61; обнаружена у T. reesei ), Y (45/K) и YI (6/В; обнаружена у H. insolens). Кроме того, в составе целлюлолитической системы грибов обнаружены ксиланазы семейства 10/F и 11/G и маннаназ семейства 5/А1. Помимо cbh1, cbh2, egl1, egl2, egl3, egl4, egl5, xyn1, xyn2, man1, соответствующих названным выше ферментам T. reesei, в превращениях растительного субстрата учавтвуют bgl1 и bxl1 (β-глюко- и ксилозидаза), axe1 (ацетилксиланэстераза), glr1 (β-глюкуронидаза), arf1 (α-L-арабинофуранозидаза), agl1, agl2, agl3 (α-галактозидазы), которые отщепляют заместители в основных цепях гемицеллюлоз.
Основным компонентом грибных целлюлазных систем является целлобиогидролаза I, которая сохраняет конфигурацию расщепляемой связи в продуктах реакции и катализирует процессы трансгликозилирования. Низкомолекулярные субстраты она атакует преимущественно вблизи восстанавливающего конца. Активный центр целлобиогидролазы I, представляет сквозной туннель. Внутри туннеля целлюлозная цепь, по-видимому, повернута на 180ои ее нативная конформация искажена, причем свободное вращение остатков глюкозы там невозможно. Целлобиогидролаза I необходима для расщепления нативной целлюлозы, при этом участвуют все три ее составные части: КД, С-концевой ЦСД и линкер.
У целлобиогидролазы II активный центр имеет форму короткого туннеля длиной 20 Å. и соответствует отщеплению ферментом дисахарида с восстанавливающего конца полимерной молекулы субстрата. Гидролиз гликозидных связей данный фермент катализирует с обращением конфигурации у аномерного углерода.
Эндоглюканаза I Trichoderma reesei имеет активный центр в виде щели и сохраняет конфигурацию у аномерного углерода при расщеплении гликозидной связи. Эндоглюканаза I расщепляет как целлобиозиды, так и лактозиды 4-метилумбеллиферона. Фермент может содержать С-концевой ЦСД семейства I (T. reesei) и не содержать его (H. insolens).
Эндоглюканаза II грибных целлюлазных систем имеет структуру ТИМ-бочки и более специфична к восстанавливающему концу целлотетра- и гексаозы. В пентасахариде она предпочтительно гидролизует вторую от восстанавливающего конца связь.Она снижает степень полимеризации карбоксиметил-целлюлозы (КМ-целлюлозы). В ее составе имеется N-концевой ЦСД семейства I.
Кроме этих ферментов у грибов выявлены и другие типы эндоглюканаз. Эндоглюканаза IY T. reesei, принадлежащая к семейству 61, содержит С-концевой ЦСД, присоединенный к КД через линкерную последовательность. Эндоглюканаза Y выделенная из T. reesei и H. insolens , имеет небольшой КД, уложенный в 6β-бочку (семейство 45/К), и ЦСД семейства I на С-конце, состоящий из 36 аминокислот, линкерную последовательность в 23 аминокислоты. Активный центр фермента в виде канала вмещает шесть сайтов связывания глюкозных остатков (от –4 до +2) и обращает конфигурацию у аномерного центра в продуктах гидролиза.
В ферментной системе H. insolens выяалена эндоглюканаза YI, сходная по структуре целлобиогидролазе II и некоторым бактериальным эндоглюканазам семейства 6/В. Фермент не содержит ЦСД. Подобно целлобиогидролазе II фермент предпочтительно расщепляет вторую с невосстанавливающего конца гликозидную связь, обращая конфигурацию у аномерного центра.