Классификация пектолитических ферментов
Гемицеллюлазы
Как уже отмечалось, состав клеточной стенки растения различен и представлен в виде комплекса полисахаридов, которые главным образом представлены в виде длинных цепочек целлюлозы, пектина и гемицеллюлоз.
Происхождение, распределение и структурные особенности полисахаридов клеточной стенки растения определяются: видовой специфичностью; типом ткани, условиями роста и созреванием. Основные различия в строении гемицеллюлозных компонентов клеточной стенки существуют между однодольными растениями (например, зерновые растения и травы) и двудольными (например, клевер, соя) и между семенем и вегетативными частями растения.
Однодольные растения характеризуются присутствием арабиноксиланового комплекса в качестве основного гемицелюлозного каркаса. Основная структура гемицеллюлоз в двудольных растениях представляет собой ксилоглюкановый комплекс. В двудольных найдены более высокие, чем в однодольных растениях концентрации пектина. Семена содержат, главным образом, пектиновые вещества и относительно низкое количество целлюлозы.
Первичная стенка клетки зрелых, метаболически активных клеток растения (например, мезофилл и эпидерма) более чувствительна к ферментативному гидролизу, чем вторичная клеточная стенка клетки, которая, становится высоко лигнифицированной. Наблюдается высокая степень взаимодействия между целлюлозой, гемицеллюлозой и пектином в стенке клетки, поэтому ферментативная деградация этих связанных полисахаридных структур представляет собой довольно сложный процесс.
В процессах распада полисахаридов растительной клеточной стенки принимают участие: Ксиланаза, эндоксиланаза-1.4-β-ксилан-ксиланогидролаза (КФ 3.2.1.8); Пектиназа, эндополигалактуроназа -1,4-α-полигалактуронан-галактуронаногидролаза (КФ 3.2.1.15); Галактозидаза (мелибиаза)- галактозидгидролаза (КФ 3.2.1.25); Экзо-1,3-β-ксилозидаза- 1,3-β-D-ксилан-ксилогидролаза (КФ 3.2.1.32); Экзо-1,4-β-ксилозидаза -1,4-β-D-ксилан- ксилогидролаза (КФ 3.2.1.37); Эндо-1,3-β-глюканаза -1,3-β-глюкан-глюканогидролаза(КФ 3.2.1.39); L-рамнозидаза - рамнозилгидролаза (КФ 3.2.1.40); L-фукозидаза- α-фукозидгидролаза (КФ 3.2.1.51); L-арабинофуранозидаза - α-L-арабинофуранозидгидролаза (КФ 3.2.1.55); Экзо-1,3-β-глюканаза-1,3-β-глюкан-глюкогидролаза (КФ 3.2.1.58); 1,2-α-L-фукозидаза-2-O-альфа-L-фукопиранозил-β-галактозид фукогидролаза (КФ 3.2.1.63); Экзополигалактуроназа-1,4-альфа-полигалактуронан-галактуроногидролаза (КФ 3.2.1.67); Экзо-1,3-β-ксилозидаза-1,3-β-ксилан-ксилогидролаза (КФ 3.2.1.72); Эндоманнаназа-1,4-β-маннан-маннаногидролаза (КФ 3.2.1.78); Экзопектиназа, экзополигалактуроназа -,4-α-Полигалактуронан-дигалактуроногидролаза (КФ 3.2.1.82); Эндо-1,4- -D-галактаназа -1,4-β-арабиногалактан-галактаногидролаза (КФ 3.2.1.89); Эндо-1,3- -D-галактаназа -1,4-β-арабиногалактан-галактаногидролаза (КФ 3.2.1.90); Эндо-арабинаназа -1,5-α-L-арабинан-1,5-α-L-арабинаногидролаза (КФ 3.2.1.99); Экзо-β-маннаназа - 1,4-β-маннан-маннобиогидролаза (КФ 3.2.1.100).
Гемицеллюлозы после целлюлозы являются наиболее обильным возобновляемым полисахаридом в природе. Для экономичной биоконверсии растительного сырья в жидкое топливо и другие ценные химические соединения важно, чтобы гемицеллюлозы (ксиланы, галактаны, арабинаны, глюкананы, маннаны) были полностью утилизируемы. В ряде случаев, полная деградация гемицеллюлозы до мономеров не обязательна. Для сжижения арабиноксилана, например, требуется просто разрушать полисахаридный каркас ксилана до более коротких фрагментов. Это может быть достигнуто действием эндоксиланаз, в результате действия которых образуется смесь мономеров и олигомеров ксилозы, таких как, например, ксилобиоза и ксилотриоза. Эти более короткие субъединицы достаточно растворимы для последующего использования.
Известно много микроорганизмов в том числе грибов и бактерий, способных образовывать большие количества ферментов, разлагающих гемицеллюлозы. В природе они всегда проявляются вместе с другими полисахариддеградирующими ферментами.
Гемицеллюлазы (КФ 3.2.1) — это системы ферментов, катализирующих гидролиз гемицеллюлоз до мономеров их образующих. Ферменты гемицеллюлазной системы называют в соответствии с тем субстратом, расщепление которого они катализируют. Так, ферменты, катализирующие гидролиз арабиноглюкуроноксиланов, арабиноксиланов, 4-О-метилглюкуроноксиланов, называют ксиланазами, а расщепляющие глюкоманнаны, галактоглюкоманнаны, галактоманнаны — маннаназами. К гемицеллюлазам часто относят ферменты, катализирующие расщепление нейтральных пектиновых полисахаридов α-L -1,5-арабинанов, 1,4-β-D-галактанов, которые соответственно называются арабиназами и галактаназами. При расщеплении гемицеллюлоз гемицеллюлазы кооперативно или синергически взаимодействуют с участвующими в расщеплении глюкозидазами, такими как:
α -L-арабинофуранозидаза (КФ 3.2.1.55) — участвует в гидролизе арабиноглюкуроноксиланов, арабиноксиланов, α -L-l,5-apaбанов;
β -ксилозидаза (КФ 3.1.1.37) — участвует в гидролизе 1,4- β -D-ксиланов;
β -маннозидаза (КФ 3.2.1.25), α -галактозидаза (КФ 3.2.1.22), β -глюкозидаза (КФ 3.2.1.21) — участвуют в расщеплении галактоглюкоманнанов;
β -галактозидаза (КФ 3.2.1.23) — участвует в гидролизе β -D-галактанов.
Ферментативный гидролиз гемицеллюлоз изучен меньше, чем таковой для целлюлозы. Частично это связано с тем, что гемицеллюлозы, обычно имеющие разветвленную структуру, не являются гомополисахаридами (состоящими из сахарных остатков только одного типа), а представляют собой гетерополисахариды, в состав которых входит как минимум от 2 до 4 типов сахаров.
Гемицеллюлазы широко применяют при переработке растительного сырья для комплексного осахаривания гемицеллюлоз. Кроме гидролиза гемицеллюлоз с целью получения энергии (в виде жидкого топлива) и различных химических соединений, гемицеллюлазы применяются в пищевой промышленности для обработки фруктов, овощей, круп, бобовых, в хлебопечении и пивоварении. С помощью этих ферментов можно получить глюкозу и пентозы, которые могут использоваться для производства кормовых белковых препаратов, в кормопроизводстве, для получения фурфурола, этанола, ксилита, биогаза и других продуктов микробного синтеза.
В зависимости от типа гидролизуемого субстрата, все ферменты гемицеллюлазного комплекса делятся на ксиланазы, галактаназы, маннаназы, арабинаназы (табл.7).
Таблица 7
Характеристика ферментов, участвующих в гидролизе гемицеллюлоз
| Фермент | Субстрат | Конечный продукт реакции | Тип гидролизуемой связи |
| β-Ксилозидаза (КФ 3.2.1.37) | Ксилан, ксилооли-госахариды | Ксилоза | β -1,4- |
| Эндоксиланаза (КФ 3.2.7.8) | Ксилан (линейный и разветвленный) | Ксилобиоза и ксилотриоза | β -1,4-; α-1,2-; α -1,3- |
| Ксилан (линейный и разветвленный) | Ксилоолигосахариды | β -1,4-; α -1,2-; α -1,3- | |
| Ксилан линейный | Олигосахариды | β -1,4- | |
| Ксилан (линейный и разветвленный) | Ксилобиоза и ксилоза | β - 1,4-; α-1,2- | |
| α-L-арабинофу-ранозидаза (КФ 3.2.1.55) | Арабиноксилан (боковые цепи); арабинан; арабино-галакган; арабино-олигосахариды | L-арабиноза | α-1,5-; α -1,3- |
| α-D-глюкурони-даза | Ксилан (боковые цепи) | D-глюкуроновая кислота; ксилан | α -1,3- |
| Ацетилэстераза (КФ 3.1.1.6) | Ацетилированный ксилан | Ацетат; ксилан | |
| Эндо-1,4-β-D-галактаназа (КФ 3.2.1.89) | 1,4- D -галактан | Галактоолиго-сахариды; галактоза | β -1,4- |
| β-1,3-О-галакта-наза | Арабино-1,3-D-га-лактан | L-арабиноза; D-гaлактоза; галактобиоза; β -D-галактооли-госахариды | β -1,3- |
Ксиланазы
Ксиланазами называют системы ферментов, катализирующих гидролиз ксиланов, арабиноксиланов, арабиноглюкуроноксиланов, глюкуроноксиланов, 4-О-метилглюкуроноксиланов до моносахаридов и уроновых кислот. На рис. 36 показана структура растительного ксилана и места, в которых он может быть атакован ксиланолитическими ферментами. Линейная структура 1,4- β -D-ксилана, состоящая из остатков D-ксилозы, разветвлена гете-рополисахаридами с образованием боковых цепей. Точки ветвления содержат L-арабинофуранозу, связанную с мономерными остатками ксилозы α -1,3-связью, и D-глюкуроновую кислоту (или 4-О-метил- D -глюкуроновую кислоту), соединенных с ксиланом α -1,2-связью. Ксилан может быть также ацетилирован. Более часто ацетилирование встречается у гидроксильных групп в положении 3, чем в 2.
Ферменты, катализирующие расщепление ксиланов, образуют бактерии, актиномицеты, фитопатогенные грибы и грибы-сапрофиты, простейшие, моллюски, насекомые, высшие растения. Ксиланазы были обнаружены в тканях позвоночных животных и человека. У позвоночных животных ксиланы гидролизуются бактериальной флорой кишечного тракта. В расщеплении 1,4-β-D-ксиланов, глюкуроноксиланов, арабиноглюкуроно-ксиланов участвуют следующие ферменты:
КФ 3.2.1.8 — эндр-1,4-β-ксиланаза, 1,4-β-D-ксиланксилано-гидролаза, характеризующаяся эндодействием на 1,4- β-D -ксилозидные связи в ксиланах.
КФ 3.2.1.37 — экзо-1,4- β -ксилозидаза, которая гидролизует 1,4- β-D-ксиланы с последовательным отщеплением остатков D-ксилозы от нередуцирующего конца.
КФ3.2.1.55—α-L-арабинофуранозидаза,
α-L-арабинофуранозидарабинофураногидролаза катализирует гидролиз концевых нередуцирующих остатков α -L-арабинофуранозидных остатков в α-L-арабинофуранозидах, α -L-арабинанах, содержащих 1,3- и (или) 1,5- связи, до арабиноксиланов и арабиногалактанов.
Многочисленные ксиланазы различного молекулярного веса известны y таких микроорганизмов как, например, Aspergillus niger, Clostridium thermocellum, Trichoderma reesei, Penicillium janthinellum, а так же у Вacillus и Streptomyces. В дрожжах - Trichosporon, Cryptococcus и Aureobasidium было выявлено только по одной ксиланазе.
Между физическими характеристиками ксиланаз грибного и бактериального происхождения существуют некоторые различия. Первые имеют рН оптимум в диапазоне рН 3,5-5,5, а бактериальные - 5,0-7,0. Грибные ксиланазы также имеют более широкий pН диапазон стабильности (pН 3-10), чем их бактериальные аналоги (pН 5,0-7,5). Температурный оптимум у грибных ксиланаз около 50ºС, а для бактериальных ксиланаз он лежит между 50 и 70ºС. Ясно, что бактериальные ксиланазы меньше подходят для использования в процессах, требующих более низких условий рН. С другой стороны, эти же ферменты слишком термостабильные для некоторых применений как, например, осветление пива.
Ac Araf
|  |
| 
3 3
- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1- 4Xyl1-
2 2 2
|  |
| 
 |
| 
Ac
MeGlcA MeGlcA
- 4Xyl1- 4Xyl1-

 β- ксилозидаза (КФ 3.2.1.37)
β- ксилозидаза (КФ 3.2.1.37)
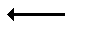 α-L-арабинофуранозидаза (КФ 3.2.1.55)
α-L-арабинофуранозидаза (КФ 3.2.1.55)
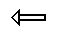 α-глюкуронидаза (3.2.1.)
α-глюкуронидаза (3.2.1.)
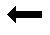 ацетилэстераза (КФ 3.1.1.6)
ацетилэстераза (КФ 3.1.1.6)
 эндо-1,4-β-ксиланаза (3.2.7.8)
эндо-1,4-β-ксиланаза (3.2.7.8)
Рис. 36. Гипотетический растительный ксилан и места, в которых он может быть атакован ферментами: Ac -ацетильные группы; Araf- арабинофураноза; MeGlcA -4-О-метил-D-глюкуроновая кислота; D -глюкуроновая кислота; Xyl- D-ксилоза
Механизм гидролиза ксиланазного полимера должен быть сходным с аналогичным процессом у других карбогидраз (в том числе и целлюлаз), где два кислых остатка аминокислот выступают в качестве нуклеофила и кислотно-основного катализатора. Так, ксиланаза из Bacillus pumilus DSM штамм 6124 имеет в каталитическом центре два глутамата - Glu 93 и Glu 182
Расщепление ксиланов у эволюционно отдаленных организмов происходит с участием ферментов семейств 10/F и 11/G. Ферменты семейства 10, более предпочтительно действуют вблизи восстанавливающего конца полимера, подобно грибной эндоглюканазе II. Их активный центр имеет форму расщелины и состоит из шести сайтов связывания пиранозных остатков: -2,-1,+1,+2,+3,+4. Протяженность агликоновой части активного центра согласуется со способностью ферментов к трансгликозилированию при низких концентрациях акцептора.
Небольшие по размерам ксиланазы II грибов, принадлежащие к семейству 11 тмеют активный центр в виде ложбины. Он образован у них завернутыми краями β-сэндвича и содержит два каталитически активных остатка E86 (предположительно нуклеофил) и E177 (предположительно общий кислотно-основной катализатор). В процессе катализа активный центр претерпевает конформационные изменения, в ходе которых изменяется положение остатков Y137 и L164. В конформации, подготовленной для связывания субстрата, активный центр открыт, а при связывании он закрывается, причем каталитически активный остаток E177 в этих условиях меняет положение в зависимости от рН. Активный центр частично приоткрыт в “ослабленной” конформации и делает возможной диффузию отщепленной части субстрата.
Более десятка грибных гемицеллюлаз несут ЦСД и вовлечены в реакции на поверхности целлюлозы. Известны два типа таких ферментов – это ксиланаза Fusarium oxysporum (семейство 10/F) и β-маннаназа T. reesei (семейство 5/А1). Эти ферменты, очевидно, участвуют в деградации той части ксиланов и маннанов, которая тесно ассоциирована с поверхностью целлюлозы и имеет более упорядоченную надмолекулярную структуру.
Грибные ксиланазы семейств 10/F и 11/G отличаются по характеру действия на метилглюкуроноксилан и родименан (1,3(4)-β-ксилан). Более высокомолекулярные ферменты семейства 10 образуют из этих субстратов в качестве минимальных фрагментов альдотетрауроновую кислоту и (Xyl)3 с центральной 1,3-β-связью, соответственно. Низкомолекулярные ферменты семейства 11 из T. reesei и стрептомицетов образуют пентамер и (Xyl)4, что свидетельствует о меньшем, чем у семейства 11 субстрат-связывающем участке активного центра у ксиланаз семейства 10, несмотря на больший размер КД со структурой ТИМ-бочки. Некоторые ферменты семейства 10 превращают не только ксилозиды, но и соответствующие β-глюкозиды. Отмечена способность ряда ферментов семейства 10 отщеплять ароматический хромо- или флуорофор от β-целло- или -ксилобиозидов. Оба семейства ферментов (10 и 11) сохраняют конфигурацию при аномерном центре.
В составе термостабильных модульных ксиланаз термофильных бактерий Caldibacillus cellulovorans и Caldicellulosiruptor cellulolyticum выявлен особый тип ксилансвязывающего домена, который первоначально получил название TSD (thermostabilizing domain), так как его удаление приводило к снижению температурного оптимума действия ксиланаз на 10ºС. У него, затем была обнаружена способность связываться с растворимым ксиланом и оксиэтилцеллюлозой. Содержащая его модульная эндоксиланаза XynA на N-конце имеет на С-конце дополнительно два ЦСД семейства IIIb.
У анаэробной бактерии Fibrobacter succinogenes ксиланаза С состоит из двух КД семейства 11/G и третьего домена невыясненной природы. Первый из доменов активен по отношению к ксилану, второй – к арабиноксилану. Анаэробная бактерия Ruminococcus flavefaciens содержит ксиланазу А, которая состоит из N-концевого домена семейства 11/G, образующего ксилоолигосахариды при гидролизе ксилана, и С-концевого домена семейства 10/F, образующего ксилозу. Ксиланаза D содержит тот же N-концевой домен, но присоединенный к С-концевой 1,3(4)-β-глюканазе. Еще одним примером являются ксиланазы псевдомонад, домены которых выполняют роль сопряженного фермента - ацетилксиланэстеразы.
Расшифровка нуклеотидных последовательностей генов, кодирующих два типа ксиланаз и ацетилксиланэстеразу из Streptomyc thermoviolaceus OPC-520 показала, что они кодируют белки 51, 35.2, и 34.3 kDa соответственно, которые, как и большинство целлюлаз, содержат по две функциональные области - каталитический и субстрат связывающий домены.
Ген ацетилксиланэстеразы AxeA анаэробного гриба Orpinomyces sp. PC-2 кодирует полипептид из 313 остатков с массой 34,845 Da. Из рекомбинантной E. coli выделен активный белок, выделяющий ацетат из ацетилксилана. Ацетилксиланэстераза (AxeA) на 56 % идентична BnaA ацетилксиланэстеразе Neocallimastix patriciarum, но не содержит некаталитического повтора (NCRPD) на С-конце как у Neocallimastix BnaA. Отсутствие докерина показывает, что AxeA может быть свободно функционирующим ферментом, а BnaA – компонентом целлюлазно-гемицеллюлазного аггрегата. Эти ферменты, по-видимому, представляют собой новое семейство гидролаз.
Ксиланазы XynY и XynZ клостридий состоят из нескольких доменов. C- и N-концевой домены XynY и XynZ, соответственно, гомологичны ферулоилэстеразе анаэробного гриба Orpinomyces PC-2. Целлюлосомы C. thermocellum гидролизуют FAXX (O-5-O-[(E)-ферулоил]-α-L-арабинофуранозил-(1,3)-O-β-D-ксилопиранозил-(1,4)-D-ксилозу) и FAX(3) (5-O-[(E)-ферулоил]-[O-β-D-ксилопиранозил-(1,2)]-O-α-L-абинофуранозил-[1,3]-O-β-D-ксилопиранозил-(1,4)-D-ксилозу) с образованием ферулата. Домены XynY и XynZ, клонированные в Escherichia coli, гидролизовали FAXX and FAX(3). FAE(XynZ) и FAE-CBD(XynZ).
Ксиланаза А бактерии P. fluorescens subsp. сellulosa принадлежит семейству 10/F, действует, очевидно, с восстанавливающего конца и способна к трансгликозилированию при относительно низких концентрациях субстрата. Особенностью ее структуры является наличие Са2+-связывающего сайта. Она несет N-концевой ЦСД семейства IIа и внутренний ЦСД семейства Х, как и эндоглюканазы. В отличие от нее XynB/C и XynD, принадлежащие тому же семейству 10/F, имеют только N-концевой ЦСД типа IIa, а XynE семейства 11 – только С-концевой ЦСД типа Х.
Ксиланаза из Pseudomonas fluorescens subsp. cellulosa одна из описанных ксиланаз, которая имеет в своей структуре участок, связывающий кальций, хотя большинство известных глюкозилгидролаз не связывают Ca2+. Возможно, что связывание кальция может стабилизировать структуру фермента от термической инактивации и (или) протеолитической атаки.
Новое применение ксиланаз основано на их способности, удалять лигнин из древесной пульпы, что сокращает количество хлора, необходимое для отбеливания, и, соответственно, снижает токсичность промышленных стоков.
Предварительная обработка с использованием ксиланаз сократила потребность в хлоре для отбеливания на 20- 25% для лиственных и только на 10 - 15% для хвойных пород. Показано, что молекулярный размер ксиланаз и структура поры пульпы определяют количество лигнина, который может быть удален с помощью ксиланаз.
Так, при использовании ксиланаз с молекулярными весами 20.000 Da, 39.000 Da и 67.000 Da из лиственной пульпы удаляется 48% 39%, и 30% лигнина соответственно.
Для увеличения размеров пор пульпы можно проводить предобработку целлюлазами, что дополнительно уменьшает затраты хлора на отбеливание - 31% для хвойной и 41,8% для лиственной пульпы.
Арабиназы
Арабинаны встречаются в зерне, фруктах, овощах, в древесине. Они состоят из α -L-арабинофуранозильных остатков, соединенных 1.5-связью, а в боковых цепях α- 1.3-связью. К ферментам, катализирующим гидролиз α -L-арабиннанов, относятся:
1. Арабинозидаза, α -L-арабинофуранозидаза (КФ 3.2.1.55), которая активна по фенил-α-L-арабинофуранозиду (α -(1-5)-) и разветвленным арабинанам (α -(1-3)-) с более высокой редуцирующей активностью по линейному 1,5-a-L-
арабинану. Фермент отщепляет мономеры L-арабинозных еди
ниц от невосстанавливающего конца субстрата, а
также способны отщеплять α-L-арабинофуранозильные сахар
ные остатки от арабиноксиланов и арабиногалактанов. L-Араби-
ноза является конкурентным ингибитором для ферментов этого
типа.
2. Арабинан-эндо-1,5- α-L-арабинозидаза (эндо-1,5-а-Ь-арабиназа) (КФ 3.2.1.99) осуществляет эндогидролиз 1,5- α-L -арабиноз-фуранозильных связей 1,5-арабинанов. Арабиназы синтезируют бактерии, грибы, высшие растения и беспозвоночные. Наиболее изучены α-L-арабиназы грибов. У грибов найдены арабиназы, связанные с клеткой, и внеклеточные. Оптимальная активность α-L-арабиназ грибов отмечается при рН 2,5-6. Молекулярныемассы этих ферментов обычно варьируют в пределах 15-63 кДа, но у Sclerotinia fructigena была найдена арабиназа с молекулярной массой 200-350 кДа.
Описаны арабинофуранозидазы, которые не проявляют активности по отношению к полимерным линейным и разветвленным арабинанам, но способны деградировать арабиноолигосахариды.
Галактаназы, манназы
Описаны два типа галактанов: состоящие из цепей β-D-галактопиранозильных остатков, соединенных либо 1,4-, либо 1,3- связью. Основная цепь молекулы галактана с -1,3- связью содержит при 6 атоме углерода 1,6-β-последовательности β-D-галактопиранозильных остатков и L-арабинофуранозильные группы в 3 и 6 положениях. β-1,4- галактаны могут существовать как сами по себе, так и быть связанными с L-арабинофуранозильными группами или остатками глюкурониловой или галактуроновой кислот.
Известен фермент, гидролизующий случайным образом арабиногалактан в кофейных зернах до L-арабинозы, D-галактозы, галактобиозы (β-1,6-связь) и серию β-D-галактоолигосахаридов.
Клонированы также эндоманнаназа Мan26А и β-маннозидаза Мan2A Cellulomonas fimi. Man26A – секретируемый модульный белок из 951 остатка с КД семейства 26, модулем S-слоя и двумя доменами неизвестной функции. Эндоманнаназа Man26A частично ассоциирована с клетками у С. fimi. и у исходного организма является очевидно единственной маннаназой. β-маннозидаза Man2A является внутриклеточным ферментом с КД из семейства 2.
В расщеплении арабиногалактанов и галактоглюкоманнанов участвуют нижеприведенные ферменты:
КФ 3.2.1.89 — эндо-1,4-β-D-галактаназа, галактаназа, араби-ногалактан эндо-1,4- β-D-галактозидаза, катализирует эндогидролиз 1,4- β-D -галактозидных связей в арабиногалактанах. Обнаружены у бактерий, грибов, высших растений. Арабиногалактан соевых бобов под действием бактериальных 1,4-р-галактаназ расщепляется до галактозы, галактобиозы, галактотриозы. Арабиноза не была найдена даже при деградации арабиногалактана на 28-34%.
КФ 3.2.1.23 — β -галактозидаза, β-D-галактозидгалактогидролаза, катализирует гидролиз концевых невосстанавливающих β-D-галактозных остатков в β-D-галактозидах. Этот фермент синтезируют грибы, дрожжи, бактерии, высшие растения, животные. Бактерии в большинстве своем образуют внутриклеточные β-галактозидазы. Микроскопические грибы синтезируют внеклеточные и внутриклеточные β -галактозидазы.
КФ 3.2.1.22 — α-галактозидаза, α- D -галактозидгалактогидро-лаза катализирует гидролиз концевых невосстанавливающих, α -D-галактозных остатков в α -D-галактанах. Кроме гидролитической активности проявляет трансгликозилирующую активность. Этот фермент обнаружен у бактерий, актиномицетов, грибов, дрожжей, высших растений, в организмах животных, человека. Молекулярные массы a-галактозидаз из бактерий около 300-370 кДа. У грибов обнаружены высокомолекулярные (500 кДа) и низкомолекулярные (45 кДа) α-галактозидазы.
КФ 3.2.1.78 — эндо-1,4-β-D-манназа, маннан-эндо-1,4- β-D -маннозидаза катализирует неупорядоченный гидролиз 1,4- β-D -маннозидных связей в галактоманнанах, глюкоманнанах, маннанах. Образуют эндо-1,4- β-D-манназы бактерии, грибы, высшие растения, беспозвоночные животные. Молекулярная масса фермента колеблется в пределах 22-47 кДа.
КФ 3.2.1.25 — β -маннозидаза, катализирует гидролиз концевых невосстанавливающих р-В-маннозидных остатков в β-D -маннозидах.
КФ 3.2.1.100 — маннан-1,4- β -маннобиозидаза, экзо-1,4-β-маннобиогидролаза катализирует гидролиз 1,4- β-D -маннозидных связей в 1,4- β-D маннанах, чтобы последовательно отщеплять ман-нобиозные остатки от невосстанавливающих концов цепи.
Расщепление галактоманнана микроорганизмами рубца происходит по схеме:
Галактоманнан → Маннан
α-Галактозидаза ↓ ↓ Эндо-1,4-β-маннаназа
Галактоза Маннодекстрины
↓ β-Маннозидаза
Манноза
Пектиназы
Пектиновые вещества многокомпонентны и входят в состав всех растительных тканей; регулируют водный обмен растений; являются промежуточным звеном в поглощении и транспорте ионов. Молекулярная масса пектинов, выделенных из различных материалов, колеблется в пределах от 20 до 360 кДа.
Гидролиз пектиновых полисахаридов в природных биоценозах осуществляют микроорганизмы. Высшие животные и человек не продуцируют пектолитические ферменты. Распад пектиновых веществ происходит под действием ферментов микрофлоры кишечника. Пектолитические ферменты (пектиназы) содержат многие растения, но они не являются промышленными источниками получения ферментов. Наибольшей продуцирующей способностью обладают микроскопические грибы рода Aspergillus. Различные виды грибов рода Penicillium, Botrytis, Trichoderma, Fusarium, Sclerotinia также продуцируют пектолитические ферменты. Способность к биосинтезу пектиназ отмечается у различных бактерий родов Clostridium, Bacillus, Pseudomonas, Erwinia, Xanthomonas.
Пектиназы рассматриваются как ферменты, модифицирующие клеточную стенку растений. После их действия другие полисахариды клеточной стенки могут атаковаться разлагающими их ферментами.
Классификация пектолитических ферментов
Пектолитические ферменты условно подразделяются на две группы: гидролазы и трансэлиминазы. В гидролизе пектиновых веществ участвуют пектинэстеразы и полигалактуроназы. Негидролитическое расщепление пектиновых веществ катализируют ферменты из класса лиаз — пектинтрансэлиминазы.
Пектинэстераза(пектинметилэстераза, КФ 3.1.1.11) гидролизует сложноэфирные связи пектина с образованием метилового спирта и полигалактуроновой кислоты с низкой степенью этерификации. Показано, что пектинэстераза (ПЭ) отщепляет СНз-группу только в том случае, если вблизи омыляемой связи находится хотя бы одна СООН-группа.
Действие ПЭ специфично по отношению к D-галактуронану. Наибольшее сродство ПЭ проявляет к метальному остатку в положении 5 (I), так как в положении 6 и 4 имеются свободные СООН-группы. Омыление эфирной связи в положениях 3 и 7 происходит во вторую очередь (II), так как сродство ПЭ к разрыву этих эфирных связей меньше, чем к той же связи в положении 5.
Механизм действия ПЭ может быть представлен в виде схемы:
ПЭ (II) ПЭ(I) ПЭ(II)

Пектинэстераза не осуществляет полную деэтерификацию пектина, а отщепляет лишь 60‑75% метильных групп. Активность фермента тем больше, чем выше степень этерификации субстрата. Скорость гидролиза снижается по мере деметоксилирования пектина и полного отщепления метоксильных групп не наблюдается. Одновалентные и двухвалентные катионы стимулируют активность фермента. Конечные продукты реакции ведут себя как конкурентные ингибиторы. Наиболее активна ПЭ бактерий при рН 7,0‑8,5. Грибная ПЭ имеет оптимум рН от 4,5 до 5,5, а полученная из растений — 6,0‑8,0.
Полигалактуроназы(ПГ) катализируют гидролиз α-1,4-глико-зидных связей в субстрате различной степени этерификации. Микроорганизмы и высшие растения обычно синтезируют по-лигалактуроназы, расщепляющие предпочтительно низкоэтери-фицированный субстрат. При воздействии на высокоэтерифицированный субстрат первая стадия гидролиза проходит под влиянием пектинэстеразы. После частичного деметоксилировния пектина начинается гидролиз полигалактуроновой кислоты. Снижение молекулярной массы пектина приводит к замедлению деметоксилирования.
Некоторые исследователи считают, что существует фермент — полиметилгалактуроназа (ПМГ), деградирующий высокоэтерифицированные α-D-галактуронаны неупорядоченным способом. Однако после открытия пектинлиазы (ПЛ) было показано, что большая часть ферментов, расщепляющих высокоэтерифицированные D-галактуронаны, действует по механизму β-элиминирования.
Среди полигалактуроназ выделяют эндо-D-галактуроназы (эндо-ПГ) и экзо-D-галактуроназы (экзо-ПГ).
Эндополигалактуроназы(КФ 3.2.1.15) катализируют гидролитическое расщепление а-1,4-гликозидных связей между неэтерифицированными остатками полигалактуроновых кислот неупорядоченным образом с предпочтительным расщеплением внутренних связей полимера. При этом происходит падение вязкости галактуронана (пектиновой или полигалактуроновой кислоты). Даже незначительное расщепление α -1,4-связей (1-10%) приводит к снижению вязкости примерно на 50%. Основными продуктами действия эндо-ПГ являются олигоурониды и небольшие количества ди- и моногалактуроновых кислот. Они могут быть получены в результате реализации либо многократного последовательного действия на единичные звенья полимера, при котором формируются эти продукты, либо в результате мультицепочеч-ного действия, при котором мономеры, димеры и тримеры образуются на конечной стадии гидролиза при расщеплении высших олигогалактуронатов.
Первый механизм обнаружен у фермента из культуры Colletotrichum lindemuthianum, а второй — у ферментов из Saccharomyces fragilis.
Активность эндо-ПГ снижается по мере расщепления субстрата. Олигоурониды гидролизуются медленнее, чем полимерный субстрат. Изучение действия эндо-ПГ на низкомолекулярные субстраты выявило три группы полигалактуроназ: А, В и С. К группе А относится полигалактуроназа из дрожжей Saccharomyces fragilis и Aspergillus niger. Она практически не способна расщеплять тример (тригалактуроновую кислоту) или гидролизу-ет его очень медленно. В группу В включена полигалактуроназа, обнаруженная у томатов и способная относительно быстро гид-ролизовать тримеры. Эта полигалактуроназа быстрее расщепляет первую связь, чем вторую от восстанавливающего конца, а третья связь от восстанавливающего конца не гидролизуется. Полигалактуроназы, найденные у культуры Erwinia carotovora, принадлежат к группе С. Они отличаются специфическим гидролизом пентасахарида, расщепляя только вторую связь от восстанавливающего конца, образуя дигалактуроновые кислоты из восстановленных или окисленных тетрамеров. Полигалактуроназа из Erwinia carotovora не расщепляет дигалактуронат, но полностью гидролизует тригалактуроновую кислоту.
Механизм действия эндо-ПГ на олигоураниды зависит от строения активного центра. Активный центр полигалактуроназы из Aspergillus niger состоит из четырех мест связывания и каталитической группы, расположенной между 1 и 2-м участками связывания. С пента- и гексамерами образуются соответственно два и три продуктивных комплекса; с тримером, когда связываются 1-3-й участки, — один продуктивный, а в случае присоединения 2-4 участков связывания — один непродуктивный комплекс. В активном центре эндо-ПГ из Aspergillus niger содержатся карбоксильные и имидазольные группы гистидина, которые участвуют в связывании фермента и субстрата.
Активность полигалактуроназ определяется по снижению вязкости растворов полигалактуроновой кислоты и содержанию восстанавливающих групп образующихся олигогалактуроновых кислот.
Большинство исследованных эндополигалакгуроназ имеют молекулярную массу 20-80 кДа. Продуцируются эндополигалакгу-роназы бактериями, фитопатогенными и сапрофитными грибами, высшими растениями. Обнаружены они и в кишечном тракте животных. У микроорганизмов найдены разнообразные формы эндополигалактуроназ. Оптимальное значение рН большинства эндо-ПГ находится в интервале от 4 до 5,5.
Экзополигалактуроназы(КФ 3.2.1.67) (экзо-ПГ) катализируют гидролиз α-1,4-гликозидных связей между остатками неэтери-фицированной галактуроновой кислоты в полигалактуроновой кислоте, пектатах. Экзо-ПГ не гидролизуют пектаты полностью. Степень гидролиза обычно составляет 40-50%. При действии экзо-ПГ падение вязкости раствора пектата на 50% сопровождается расщеплением 30-45% гликозидных связей.
Грибные экзополигалактуроназы проявляют максимальную активность при рН 4-6 и образуют в качестве основного конечного продукта моногалактуроновую кислоту. Фермент из бактерий Erwinia aroideae атакует субстрат с нередуцирующего конца цепи при рН 7,2, образуя моно- и дигалактуроновую кислоту.
Экзо-ПГ с большей скоростью гидролизует частично деградированный субстрат. Однако в некоторых случаях длина цепи не определяет скорость гидролиза субстрата. Так, внеклеточная экзополигалактуроназа из Aspergillus niger не проявляет строгой специфичности к длине цепи субстрата.
Олигогалактуроназы(КФ 3.2.1.40) (ОГ) синтезируются рядом микроорганизмов. Это внутриклеточные ферменты, гидролизующие предпочтительно низкомолекулярные олигогалактурониды. Олигогалактуроназа атакует субстрат с нередуцирующего конца. Наиболее активна олигогалактуроназа по отношению к тримеру, с возрастанием степени полимеризации ее активность уменьшается.
Пектинтрансэлиминазы, или пектатлиазы (ПТЛ), осуществляют расщепление a‑1,4-гликозидных связей в субстрате путем b‑элиминирования. При b‑элиминировании происходит удаление атома водорода от 5‑го углеродного атома (С5). В результате потери водорода между С5 и С4 образуется двойная связь (рис.37).
Продукты элиминативного расщепления содержат двойные связи и карбоксильные группы. Они активно поглощают ультрафиолетовый свет с длиной волны 235 нм, а также дают цветную реакцию с тиобарбитуровой кислотой с максимумом поглощения при 547‑550 нм.
Пектинтрансэлиминазы действуют как на пектин, так и пектовую кислоту. Гликозидные связи неэтерифицированных и низкоэтерифицированных субстратов расщепляются ПТЛ неупорядоченно, с предпочтительным разрывом внутренних связей в полимерах и путем последовательного отщепления с восстанавливающих концов ненасыщенных димеров и тримеров.

α -1,4- связь
Рис.37. Элиминативный путь расщепления пектиновых веществ
У микроорганизмов найдены внеклеточные ПТЛ, расположенные в периплазматическом пространстве, и цитоплазматические ПТЛ.
Отличительной особенностью пектолитических лиаз является их потребность в ионах кальция для активации и других двухвалентных катионов.
Различаются лиазы эндо- и экзодействия.
Эндополигалактуронатлиазы (эндопектатлиазы, КФ 4.2.2.2) (эндо-ПГЛ) синтезируются грибами и бактериями. Встречаются как конститутивные ферменты, так и индуцируемые ферменты, синтез которых происходит лишь на средах с пектином или пектатами.
Хорошими субстратами для эндополигалактуронатлиазы являются пектаты, а для ферментов из Arthrobacter и Bacillus polymyxa — пектины со степенями этерификации соответственно 21, 44, 26%. Эндопектатлиазы по способу расщепления D‑галактуронана и олигогалатуронидов делят на две группы. Первая группа эндопектатлиаз расщепляет тетрамер по центральной связи и способна также расщеплять трисахариды. В результате воздействия образуется ненасыщенный димер О‑(4‑дезокси-b-L-треогексозо-4-енопиранозил‑L‑1,4)-D-галактопирануроновая кислота. При расщеплении ненасыщенного трисахарида образуется ненасыщенный дисахарид и 4-дезокси-L-треогексозо-5-уроновая кислота.
Лиазы второй группы расщепляют в тетрамере третью связь от восстанавливающего конца, при этом образуется ненасыщенный тример.
Эндопектатлиазы первой группы обнаружены у бактерий Erwinia corotovora, Bacillus polymixa, Xanthomonas campestris, а второй группы — у анаэробной бактерии Bacillus sp.
При действии эндополигалактуронатлиаз вязкость субстратных растворов снижается пропорционально числу разрушенных гликозидных связей. С уменьшением длины цепи олигогалактуронатных субстратов падает активность эндополигалактуронатлиаз.
Экзополигалактуронатлиазы (экзопектатлиазы, КФ 4.2.2.9) (экзо-ПГЛ) отщепляют остатки ненасыщенной олигогалактуроновой кислоты от восстанавливающего конца субстратной цепи. Продукт реакции — ненасыщенный димер (дигалактуроновая кислота). Исключением является фермент из Streptomyces nitrosporeus, который образует тригалактуроновую кислоту.
Оптимальные значения рН для экзо-ПГЛ находятся в пределах 8,0‑9,5. Сродство экзополигалактуронатлиаз к полигалактуроновой кислоте и олигогалактуронатам почти одинаково. Двухвалентные катионы активируют экзополигалактуронатлиазы.
При изучении ферментов из Clostridium multifermentans было показано наличие в неочищенном ферменте пектинэстеразы. Лиаза и пектинэстераза в комплексе расщепляют молекулу пектина. Цепь полисахарида последовательно взаимодействует сначала с активным центром эстеразы, затем с активным центром лиазы без промежуточной диссоциации. При этом образование карбоксильных групп и ненасыщенных димеров идет в отношении 2:1.
Олигогалактуронатлиазы (КФ 4.2.2.6) (ОГЛ) являются внутриклеточными ферментами, которые синтезируются рядом микроорганизмов, в том числе Erwinia carotovora, Erwinia aroideae, Pseudomonas sp. Они катализируют расщепление первой гликозидной связи от восстанавливающего конца у насыщенных и ненасыщенных олигогалактоуронидов, образующихся при действии ПТЛ и ПГ. Из ненасыщенных олигогалактуронатов формируются только ненасыщенные мономеры, а при действии ОГЛ на насыщенные олигогалакуронаты — насыщенные мономеры и отдельные молекулы D‑галактуроновой кислоты.
Олигогалактуронатлиаза из Erwinia aroideae с большей скоростью расщепляет ненасыщенные олигоурониды, чем насыщенные. Максимальную активность наблюдали при рН 7,0.
С одинаковой скоростью расщепляет ненасыщенные и насыщенные олигоурониды олигогалактуронатлиаза из Pseudomonas sp. При этом Са++ стимулирует активность, максимальная активность наблюдается при рН 6,4.
Эндополиметилгалактуронатлиазы (пектинлиазы, КФ 4.2.2.10) продуцируются грибами. Они расщепляют высокоэтерифицированные пектины путем неупорядоченного действия с образованием насыщенных олиго-D-галактуронатов. Полигалактуроновая кислота этими ферментами не гидролизуется. Активность полиметилгалактуронатлиаз быстро падает с уменьшением длины цепи. Субстратами с наименьшей длиной цепи, которые гидролизуются ферментами из Aspergillus fonsecalus и Aspergillus niger, являются соответственно тетраметилтетрагалактуронат и триметилтригалактуронат.
Кальций не относится к числу необходимых соединений для активации этих ферментов. Однако ионы кальция и ряда двухвалентных металлов влияют на зависимость активности фермента от рН и степени этерификации субстрата.