Розчини електролітів. Визначення рН розчинів
Лабораторна робота № 9
Мета роботи: вивчення властивостей розчинів електролітів. Придбання навичок визначення рН розчинів.
Дослід 1. Залежність рН розчину ацетатної кислоти від концентрації.
Розрахунок ступеня дисоціації.
За допомогою універсального індикаторного паперу визначити рН розчину ацетатної кислоти з концентраціями 1 М і 0,01 М. Для цього скляною паличкою перенести 1-2 краплі досліджуваного розчину на універсальний індикаторний папір і порівняти забарвлення сирої плями з кольоровою шкалою. Записати рівняння реакції дисоціації та вираз для константи дисоціації ацетатної кислоти. Визначити ступінь дисоціації кислоти, враховуючи, що вона є слабким електролітом :
a =  ; Кд (кисл)= 1.105.
; Кд (кисл)= 1.105.
Розрахувати рН розчинів ацетатної кислоти, передбачаючи, що концентрація йонів Гідрогену в розчині дорівнює концентрації продисоційованих молекул:
[H+] = aC, pH = lg [H+].
Одержані дані внести в таблицю і зробити висновок про вплив концентрації на ступінь дисоціації слабкого електроліту.
| Концентрація СН3СООН, моль/л | [H+] | pHрозр | рН визн | |
| 0,01 |
Дослід 2. Порівняння хімічної активності кислот
В одну пробірку налити 2 мл 2 М розчину хлороводневої кислоти, в другу стільки ж 2 М розчину ацетатної кислоти. В кожну пробірку додати по одному шматочку цинку. В якому випадку водень виділяється енергійніше? Написати йонні та молекулярні рівняння реакцій. Пояснити різницю швидкостей реакцій, які спостерігали.
Дослід 3. Вплив солі слабкої кислоти на дисоціацію цієї кислоти
В дві пробірки помістити по 1-2 мл 0,01 М ацетатної кислоти і додати по одній – дві каплі індикатора метилоранжу. Одну пробірку залишити для порівняння, а в другу додати кілька кристалів натрій ацетату і добре перемішати. Порівняти забарвлення в обох пробірках і пояснити його зміни, виходячи з принципу ле Шательє і виразу константи дисоціації ацетатної кислоти. Яку речовину треба додати до розчину слабкої кислоти, щоб змістити рівновагу в бік утворення малодисоційованих молекул?
Дослід 4. Вплив солі слабкої основи на дисоціацію цієї основи
В дві пробірки поміститити по 1-2 мл розчину амоніаку і додати по одній краплі розчину фенолфталеїну. В одну пробірку додати кілька кристалів солі амоній хлориду і добре розмішати. Пояснити зміну забарвлення розчину при додаванні солі, виходячи з принципу ле Шательє і виразу константи дисоціації. Яку речовину треба додати до розчину слабкої основи, щоб змістити рівновагу в бік утворення малодисоційованих молекул?
Дослід 5. Зміщення іонноі рівноваги в насиченому розчині амфотерного електроліту.
До розчину солі цинку додати краплями розбавлений розчин NaOH до утворення осаду гідроксиду цинку. Поділити осад на 2 частини. До однієї частини долити надлишок розчину хлороводневої кислоти, а до другої - надлишок концентрованого розчину лугу NaOH. Що спостерігається у першому і в другому випадках? Пояснити зміну йонної рівноваги в насиченому розчині цинк гідроксиду. Скласти рівняння реакцій розчинення цинк гідроксиду в кислотному і лужному середовищах, враховуючи, що амфотерний гідроксид погано розчиняється у воді, а у лужних розчинах утворюється комплексна сполука.
Дослід 6. Реакції з утворенням осадів.
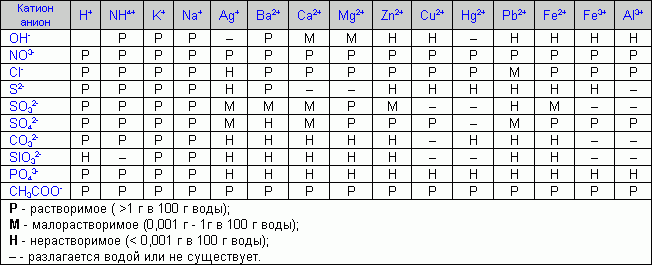
За допомогою таблиці розчинності визначити, які сполуки можливо використати для осадження йонів Ba2+, Zn2+, Fe2+. Зробити реакції утворення осадів з солями Na2CO3 та K3PO4 і вказати колір осадів. Написати рівняння реакцій в молекулярному та йонному вигляді.