Психосоциальное вмешательство
Болезнь Альцгеймера
Болезнь Альцгеймера — наиболее распространённая форма деменции, впервые описанное в 1907 году немецким психиатром Алоисом Альцгеймером. Как правило, она обнаруживается у людей старше 65 лет, но существует и ранняя болезнь Альцгеймера — редкая форма заболевания.
Как правило, болезнь начинается с малозаметных симптомов, но с течением времени прогрессирует. Наиболее часто на ранних стадиях распознаётся расстройство кратковременной памяти, например, неспособность вспомнить недавно заученную информацию. С развитием болезни происходит потеря долговременной памяти, возникают нарушения речи и когнитивных функций, пациент теряет способность ориентироваться в обстановке и ухаживать за собой. Постепенная потеря функций организма ведёт к смерти.
При обращении к врачу и подозрении на болезнь Альцгеймера для уточнения диагноза обычно анализируют поведение, проводят серию когнитивных тестов, если возможно, проводится магнитно-резонансная томография (МРТ). Болезнь может развиваться скрыто на протяжении длительного времени, прежде, чем станут заметны симптомы и будет поставлен диагноз. Средняя продолжительность жизни после установления диагноза составляет около семи лет, менее трёх процентов больных живут более четырнадцати лет.
Ключевыми особенностями болезни являются накопление амилоидных бляшек и нейрофибриллярных клубков в тканях мозга. Как для предупреждения, так и для борьбы с болезнью рекомендуют заниматься физическими упражнениями, стимулировать мышление и придерживаться сбалансированной диеты.
Болезнь Альцгеймера принадлежит к заболеваниям, накладывающим самый тяжёлый финансовый груз на общество в развитых странах.
Врачи и философы Древней Греции и Рима связывали старость с ослаблением рассудка, однако в 1901 году немецкий психиатр Алоис Альцгеймер отметил случай болезни, которая впоследствии была названа его именем. Диагноз болезни Альцгеймера на протяжении большей части двадцатого века ставили лишь относительно молодым пациентам, у которых первые симптомы деменции появились в возрасте от 45 до 65 лет.
Эпидемиология
Годы жизни, скорректированные по нетрудоспособности при болезни Альцгеймера и других деменциях на 100,000 населения в 2004 году.
Два основных показателя, используемых в эпидемиологических исследованиях — заболеваемость ираспространённость заболевания. Заболеваемость отражает число новых случаев на единицу человеко-времени, а распространённость заболевания говорит об общем числе поражённых болезнью в популяции на конкретный момент времени.
Пожилой возраст является главным фактором риска, что отражается в статистике: на каждые пять лет после 65-летнего возраста показатель риска увеличивается примерно вдвое, вырастая от 3 случаев в 65 лет до 69 случаев на тысячу человеко-лет к 95 годам, Существуют и половые различия — женщины чаще заболевают болезнью Альцгеймера, в особенности после 85 лет.
Распространённость болезни в популяции, зависит от различных факторов, в том числе от заболеваемости и смертности. Поскольку заболеваемость растёт с возрастом, необходимо непременно учитывать средний возраст населения в исследуемой местности. В США по состоянию на 2000 год около 1,6 % населения, как в целом, так и в группе 65-74 лет, имели болезнь Альцгеймера. В группе 75-84 лет этот показатель составлял уже 19 %, а среди граждан, чей возраст превысил 84 года, распространённость болезни составляла 42 %. В менее развитых странах распространённость болезни ниже. По данным ВОЗ, в 2005 году деменцией страдали 0,379 % мирового населения, а прогноз на 2015 год достигает значения 0,441 % и ещё больший процент населения, 0,556 %, может быть поражён болезнью к 2030 году. К подобным выводам приходят и авторы других работ . Ещё одно исследование говорит о том, что в 2006 году распространённость болезни в мире составляла 0,40 % (разброс 0.17-0.89 %, абсолютное количество — 26.6 млн человек, с разбросом 11.4-59.4 млн) и предсказывает, что долевой показатель вырастет втрое, а абсолютное количество больных — вчетверо к 2050 году.
Характеристика
Ход болезни подразделяют на четыре стадии, с прогрессирующей картиной когнитивных и функциональных нарушений.
Предеменция
Первые симптомы часто путают с проявлениями старения или реакцией на стресс. Наиболее ранние когнитивные затруднения выявляются у некоторых людей при детальном нейрокогнитивном тестировании за восемь лет до постановки диагноза. Наиболее заметно расстройство памяти, проявляющееся в затруднении при попытке вспомнить недавно заученные факты и в неспособности усвоить новую информацию. Малозаметные проблемы исполнительных функций: сосредоточенности, планирования, когнитивной гибкости и абстрактного мышления, либо нарушение семантической памяти, также могут быть симптомом ранних стадий болезни Альцгеймера. На этой стадии может отмечаться апатия, которая остаётся самым устойчивым нейропсихиатрическим симптомом на всём протяжении заболевания. Также преклиническую стадию называют, «мягким когнитивным снижением»[ или «умеренным когнитивным нарушением».
Ранняя деменция
Прогрессирующее снижение памяти и агнозия при болезни Альцгеймера рано или поздно ведут к подтверждению диагноза. У небольшого числа пациентов при этом на первый план выступают не расстройства памяти, а нарушения речи, исполнительных функций, восприятия либо двигательные нарушения (апраксия). Старые воспоминания о собственной жизни и давно заученные факты в меньшей степени подвержены расстройству по сравнению с новыми фактами или воспоминаниями. Афазия в основном характеризуется оскудением словарного запаса и сниженной беглостью речи, что в целом ослабляет способность к словесному и письменному выражению мыслей.
Умеренная деменция
Способность к независимым действиям снижается из-за прогрессирующего ухудшения состояния. Расстройства речи становятся очевидными, так как с потерей доступа к словарному запасу человек все чаще подбирает неверные слова на замену забытым (парафразия). Также идет потеря навыков чтения и письма. Со временем всё более нарушается координация при выполнении сложных последовательностей движений, что снижает способность человека справляться с большинством повседневных задач. На этом этапе усиливаются проблемы с памятью, больной может не узнавать близких родственников. Может развиться недержание мочи.
Тяжелая деменция
На последней стадии болезни Альцгеймера пациент полностью зависит от посторонней помощи. Владение языком сокращается до использования единичных фраз и даже отдельных слов, и в итоге речь полностью теряется. Несмотря на утрату вербальных навыков, пациенты часто способны понимать и отвечать взаимностью на эмоциональные обращения к ним. Хотя на этом этапе все ещё могут быть проявления агрессии, гораздо чаще состояние больного характеризуется апатией иистощением, и с какого-то момента он не в состоянии осуществить даже самое простое действие без чужой помощи. Больной теряет мышечную массу, передвигается с трудом и на определенном этапе оказывается не в силах покинуть кровать, а затем и самостоятельно питаться. Смерть наступает обычно вследствие стороннего фактора, такого как пролежневая язва или пневмония, а не по вине собственно болезни Альцгеймера.
Причины
Для объяснения возможных причин заболевания предложены три основные конкурирующие гипотезы: холинергическая, амилоидная и тау-гипотеза.
Холинергическая гипотеза, согласно которой болезнь вызывается сниженным синтезом нейромедиатора ацетилхолина. В настоящее время эта гипотеза считается маловероятной, поскольку медикаменты, призванные скорректировать дефицит ацетилхолина, имеют невысокую эффективность, однако на её основе было создано большинство существующих методов поддерживающей терапии.
В 1991 году была предложена «амилоидная гипотеза», согласно которой базовой причиной заболевания являются отложения бета-амилоида (A). Ген, кодирующий белок (APP), из которого образуется бета-амилоид, расположен на 21 хромосоме. К тому же APOE4, основной генетический фактор риска болезни Альцгеймера, приводит к избыточному накоплению амилоида в тканях мозга ещё до наступления симптомов.
Наряду с амилоидной гипотезой изучается тау-гипотеза, согласно которой каскад нарушений запускается отклонениями в структуре тау-белка. Предположительно, нити гиперфосфорилированного тау-белка начинают объединяться между собой, образуя в итоге нейрофибриллярные клубки внутри нервных клеток. Это вызывает дезинтеграцию микротрубочек и коллапс транспортной системы внутри нейрона, приводя сначала к нарушению биохимической передачи сигналов между клетками, а затем и к гибели самих клеток.
Патофизиология
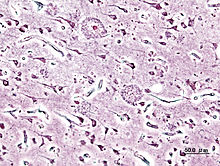
Гистопатологический образец участка коры головного мозга с сенильными бляшками.Импрегнация серебром.
Нейропатология
Болезнь характеризуется потерей нейронов и синаптических связей в коре головного мозга и определённых субкортикальных областях. Гибель клеток приводит к выраженной атрофии поражённых участков, в том числе к дегенерации височных и теменной долей, участков фронтальной коры и поясной извилины.
Как амилоидные бляшки, так и нейрофибриллярные клубки хорошо заметны под микроскопом при посмертном анализе образцов мозга больных. Бляшки представляют собой плотные, в большинстве случаев нерастворимые отложения бета-амилоида и клеточного материала внутри и снаружи нейронов. Внутри нервных клеток они растут, образуя нерастворимые закрученные сплетения волокон, часто называемые клубками. У многих пожилых людей в мозге образуется некоторое количество бляшек и клубков, однако при болезни Альцгеймера их больше в определённых участках мозга, таких как височные доли.
Биохимия
Ферменты разрезают предшественник бета-амилоида на участки, один из которых играет ключевую роль в формировании сенильных бляшек при болезни Альцгеймера.
Замечено, что болезнь Альцгеймера всегда сопровождается протеинопатией — накоплением в тканях мозга ненормально свёрнутых белков — бета-амилоида и тау-белка. Бляшки образуются из малых пептидов длиной в 39-43 аминокислоты, именуемых бета-амилоидом (тж. A-beta, A). Бета-амилоид является фрагментом более крупного белка-предшественника — APP. Этот трансмембранный белок играет важную роль в росте нейрона, его выживании и восстановлении после повреждений. При болезни Альцгеймера по неизвестным пока причинам APP подвергается протеолизу — разделяется на пептиды под воздействием ферментов. Бета-амилоидные нити, образованные одним из пептидов, слипаются в межклеточном пространстве в плотные образования, известные как сенильные бляшки
При болезни Альцгеймера изменения в структуре тау-белкаприводят к дезинтеграции микротрубочек в клетках мозга.
Более специфически, болезнь Альцгеймера относят также к таупатиям — болезням, связанным с ненормальной агрегацией тау-белка. Каждый нейрон содержит цитоскелет, отчасти составленный из микротрубочек, которые действуют подобно рельсам, направляя питательные вещества и другие молекулы из центра на периферию клетки, к окончанию аксона, и обратно. Тау-белок, наряду с несколькими другими белками, ассоциирован с микротрубочками, в частности, после фосфорилирования он их стабилизирует. При болезни Альцгеймера тау-белок подвергается избыточному фосфорилированию, из-за чего нити белка начинают связываться друг с другом, слипаться в нейрофибриллярные клубки и разрушать транспортную систему нейрона.
Патологический механизм
Неизвестно, как именно нарушение синтеза и последующее скопление бета-амилоидных пептидов вызывает патологические отклонения при болезни Альцгеймера. Амилоидная гипотеза традиционно указывала на скопление бета-амилоида как на основное событие, запускающее процесс нейрональной дегенерации. Считается, что отложения нарушают гомеостаз ионов кальция в клетке и провоцируют апоптоз. Известно, что местом скопления A в нейронах пациентов являются митохондрии, также этот пептид ингибирует работу некоторых ферментов и влияет на использование глюкозы.
Воспалительные процессы и цитокины могут играть роль в патофизиологии. Поскольку воспаление является признаком повреждения тканей при любом заболевании, при болезни Альцгеймера оно может играть вторичную роль по отношению к основной патологии либо представлять собой маркер иммунной реакции.
Генетика
Известны три гена, мутации которых в основном позволяют объяснить происхождение редкой ранней формы, однако распространенная форма болезни Альцгеймера пока не укладывается в рамки исключительно генетической модели. Наиболее выраженным генетическим фактором риска на данный момент считается APOE, но вариации этого гена ассоциированы лишь с некоторыми случаями болезни.
Менее 10 % случаев болезни в возрасте до 60 лет связаны с аутосомно-доминантными (семейными) мутациями, которые в общем массиве составляют менее 0,01 %. Мутации обнаружены в генах APP, пресенилина 1 и пресенилина 2, большинство из них усиливают синтез малого белка Abeta42, основного компонента сенильных бляшек.
В роду большинства больных не отмечается предрасположенности к заболеванию, однако гены могут отчасти обуславливать риск. Самый известный генетический фактор риска — наследуемая аллель E4 гена APOE, с которой может быть связано до половины случаев поздней спорадической болезни Альцгеймера. Генетики сходятся в мнении о том, что многие другие гены могут в какой-то степени способствовать либо препятствовать развитию поздней болезни Альцгеймера. Всего на ассоциацию с этим распространенным типом болезни проверено более 400 генов. Один из недавних примеров — вариация гена RELN, связанная с повышенной заболеваемостью у женщин].
Диагностика
PET-сканирование мозга при болезни Альцгеймера демонстрирует угасание активности в височных долях.
Клинический диагноз болезни Альцгеймера обычно основан на истории пациента (анамнезе жизни), истории его родственников и клинических наблюдений (наследственном анамнезе), при этом учитываются характерные неврологические и нейропсихологические признаки и исключаются альтернативные диагнозы. Для того, чтобы отличить болезнь от других патологий и разновидностей деменции, могут быть использованы сложные методы медицинской визуализации — компьютерная томография, магнитно-резонансная томография, однофотонная эмиссионная компьютерная томография или позитронно-эмиссионная томография. Для более точной оценки состояния проводится тестирование интеллектуальных функций, в том числе памяти. Медицинские организации вырабатывают диагностические критерии с целью облегчить диагностику практикующему врачу и стандартизировать процесс постановки диагноза. Иногда диагноз подтверждается либо устанавливается посмертно при гистологическом анализе тканей мозга.
Диагностические критерии
Американский Национальный институт неврологических и коммуникативных расстройств и инсульта (NINDS) и Ассоциация болезни Альцгеймера составили наиболее часто используемый набор критериев для диагностики болезни Альцгеймера. Согласно критериям, для постановки клинического диагноза возможной болезни Альцгеймера требуется подтвердить наличие когнитивных нарушений и предположительного синдрома деменции в ходе нейропсихологического тестирования. Для окончательного подтверждения диагноза необходим гистопатологический анализ тканей мозга, и в ходе сверки прижизненных диагнозов по критериям с посмертным анализом были отмечены хорошая статистическая надёжность и проверяемость. Чаще всего нарушения при болезни Альцгеймера затрагивают восемь доменов: память, языковые навыки, способность воспринимать окружающее, конструктивные способности, ориентирование в пространстве, времени и собственной личности, навыки решения проблем, функционирования, самообеспечения.
Методы диагностики
В диагностике болезни Альцгеймера может помочь нейропсихологическоескрининг-тестирование, при котором пациенты копируют фигуры, запоминают слова, читают, выполняют арифметические действия.
ПЭТ-сканирование: При болезни Альцгеймера, введённый в организмПиттсбургский состав Bскапливается в мозге, закрепляясь за отложения бета-амилоида (слева). Справа — мозг пожилого человека без признаков болезни Альцгеймера.
Нейропсихологические тесты, например, MMSE, широко применяются для оценки когнитивных нарушений, которые должны присутствовать при заболевании. Для получения надёжных результатов требуются более развёрнутые наборы тестов, особенно на ранних стадиях болезни. В начале болезни неврологический осмотр обычно не показывает ничего необычного, за исключением явных когнитивных отклонений, которые могут напоминать обычную деменцию. Ввиду этого, для дифференциальной диагностики болезни Альцгеймера и других заболеваний важно расширенное неврологическое исследование. Беседа с членами семьи также используется при оценке хода болезни, поскольку родственники могут предоставить важную информацию об уровне повседневной активности человека и о постепенном снижении его мыслительных способностей. Так как сам пациент обычно не замечает нарушений, точка зрения ухаживащих за ним людей особенно важна. В то же время во многих случаях ранние симптомы деменции остаются незамеченными в семье и врач получает от родственников неточную информацию. Дополнительные тесты обогащают картину информацией о некоторых аспектах болезни либо позволяют исключить другие диагнозы. Анализ крови может выявить альтернативные причины деменции, которые изредка даже поддаются терапии, обращающей симптомы вспять. Также применяются психологические тесты для выявления депрессии, которая может как сопутствовать болезни Альцгеймера, так и являться причиной когнитивного снижения.
Аппаратура SPECT- и PET-визуализации при её доступности может быть использована для подтверждения диагноза совместно с другими методами оценки, включающими анализ ментального статуса. У людей, уже страдающих от деменции, SPECT, по некоторым данным, позволяет более эффективно дифференцировать болезнь Альцгеймера от других причин, по сравнению со стандартным тестированием и рассмотрением анамнеза. Возможность наблюдать отложения бета-амилоида в мозге живых людей появилась благодаря созданию в Питтсбургском университете Питтсбургского состава B (PiB), связывающегося с амилоидными отложениями при введении в организм. Короткоживущий радиоактивный изотоп углерод-11 в соединении позволяет определять распределение этого вещества в организме и получать картину амилоидных отложений в мозге больного с помощью ПЭТ-сканера. Показано также, что объективным маркером болезни может быть содержание бета-амилоида либо тау-белка в спинномозговой жидкости. Эти два новых метода вызвали предложения о разработке новых диагностических критериев.
Профилактика заболевания
Интеллектуальная активность, в том числе увлечение игрой вшахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана.
Международные исследования, призванные оценить, насколько та или иная мера способна замедлить или предотвратить наступление болезни, нередко дают противоречивые результаты. К настоящему времени нет твердых свидетельств превентивного действия любого из рассматривавшихся факторов. Вместе с тем, эпидемиологические исследования говорят о том, что некоторые поддающиеся коррекции факторы — диета, риск сердечно-сосудистых заболеваний, приём лекарств, мыслительная активность и другие — ассоциированы с вероятностью развития болезни. Однако реальные доказательства их способности предупредить болезнь могут быть получены лишь в ходе дополнительного изучения, в которое будут входить клинические исследования.
Ингредиенты средиземноморской диеты, в том числе фрукты и овощи, хлеб, пшеница и другие крупяные культуры, оливковое масло, рыба и красное вино, возможно, способны по отдельности либо в совокупности снижать риск и смягчать течение болезни Альцгеймера. Приём некоторых витаминов, в их числе B12, B3, C и фолиевая кислота, в ходе некоторых исследований был связан со сниженным риском развития болезни, однако другие работы говорят об отсутствии значимого воздействия на начало и течение болезни и о вероятности побочных эффектов. Куркумин, содержащийся в распространённой специи, при исследовании на мышах показал некоторую способность предотвращать определённые патологические изменения в мозге.
Каприловая кислота, содержащаяся в кокосовом масле, уменьшает количество амилоидных бляшек в нейронах ствола мозга. В процессе метаболизма этого вещества образуются кетоновые тела, участвующие в энергетических процессах головного мозга. Лабораторные эксперименты подкрепляются практикой. Известна книга доктора Мэри Ньюпорт «А если это лекарство?». В ней она описывает наблюдения за своим мужем, страдающим болезнью Альцгеймера. На фоне употребления кокосового масла в течение месяца он стал успешно справляться с простыми психологическими тестами и возобновил своё участие в домашних делах.
Факторы риска сердечно-сосудистых заболеваний, такие как высокий уровень холестерина и гипертензия, диабет, курение, ассоциированы с повышенным риском и более тяжёлым течением болезни Альцгеймера, но средства, снижающие холестерин (статины) не показали эффективности в её предотвращении либо улучшении состояния больных. Долговременное применение нестероидных противовоспалительных средств ассоциировано со сниженной вероятностью развития болезни у некоторых людей. Другие лекарства, например, гормонозаместительная терапия у женщин, более не считаются эффективными в предотвращении деменции. Систематический обзор гинкго билоба, проведённый в 2007 году, говорит о непоследовательном и неубедительном характере представленных свидетельств воздействия препарата на когнитивные нарушения, а ещё одно исследование говорит об отсутствии действия на заболеваемость.
Некоторые исследования говорят о повышенном риске развития болезни Альцгеймера у тех людей, чья работа связана с воздействием магнитных полей, попаданием в организм металлов, особенно алюминия, или использованием растворителей. Некоторые из этих публикаций подверглись критике за низкое качество работы, к тому же в других исследованиях не обнаружено связи факторов внешней среды с развитием болезни Альцгеймера.
Интеллектуальные занятия, такие как чтение, настольные игры, разгадывание кроссвордов, игра на музыкальных инструментах, регулярное общение, возможно, способны замедлить наступление болезни либо смягчить её развитие. Владение двумя языками ассоциируется с более поздним началом болезни Альцгеймера.
В обзоре, опубликованном в 2015 году, канадские исследователи указывают, что психотехники, основанные на практике внимательности, могут препятствовать наступлению мягкого когнитивного нарушения и развитию болезни Альцгеймера.
Согласно недавним исследованиям, снижение когнитивных функций при болезни Альцгеймера коррелирует с наличием у пациента пародонтоза. Так, согласно данным Института Стоматологии в Королевском колледже Лондона, опубликованным в журнале PLOS One, заболевание десен связывают с шестикратным снижением когнитивных функций (выборка 59 человек, длительность наблюдения 6 месяцев). Также Журнал «Новости Медицины Сегодня» сообщал о похожем исследовании в 2014 году, когда в биоптате мозга пациентов с болезнью Альцгеймера была идентифицирована бактерия-возбудитель пародонтоза Porphyromonas gingivalis.
Терапия и уход
От болезни Альцгеймера невозможно излечиться; доступные методы терапии способны в небольшой степени повлиять на симптомы, но по своей сути являются паллиативными мерами. Из всего комплекса мер можно выделить фармакологические, психосоциальные и меры по уходу за больным.
Фармакотерапия
Трёхмерная структура донепезила, ингибитора ацетилхолинэстеразы, используемого для симптоматической терапии.
Молекулярная структура мемантина, средства, одобренного к применению при болезни Альцгеймера.
В настоящее время не существует лекарств, способных обратить или хотя бы замедлить развитие болезни Альцгеймера. Регулирующими агентствами, такими как FDA и EMEA, одобрены четыре препарата для терапии когнитивных нарушений при болезни Альцгеймера — три ингибитора холинэстеразы центрального действия и мемантин, NMDA-антагонист.
Известным признаком болезни Альцгеймера является снижение активности холинергических нейронов. Ингибиторы холинэстеразы центрального действия снижают скорость разрушения ацетилхолина (ACh), повышая его концентрацию в мозге и компенсируя потерю ACh, вызванную потерей холинергических нейронов. Первым таким ингибитором, одобренным для применения при болезни Альцгеймера, был такрин, однако в 2012 году его применение в США было запрещено из-за гепатотоксических и других побочных эффектов. По состоянию на 2008 год, врачами использовались такие ACh-ингибиторы, как донепезил, галантамин, и ривастигмин (в форме таблеток и пластыря). Есть свидетельства эффективности этих препаратов на начальной и умеренной стадиях, а также некоторые основания к их применению на поздней стадии. Только донепезил одобрен к применению при наступлении тяжелой деменции. Использование этих препаратов при мягком когнитивном нарушении не замедляет наступление болезни Альцгеймера. Среди побочных действий препаратов самыми распространёнными являются чувство тошноты и рвота, связанные с избытком холинергической активности, они возникают у 1-10 % пациентов и могут быть слабо- либо умеренновыраженными. Реже встречаются спазмы мышц, брадикардия, снижение аппетита, потеря веса, увеличение кислотности желудочного сока.
В настоящее время проводятся исследования ещё одного ингибитора холинэстеразы — гуперцина, который является также антагонистом к NMDA-рецепторам и может смягчать когнитивные нарушения у пациентов, но пока не прошёл полноценных клинических испытаний.
Возбудительный нейротрансмиттер глутамат играет важную роль в работе нервной системы, но его избыток ведет к чрезмерной активации глутаматных рецепторов и может вызывать гибель клеток. Этот процесс, называемый эксайтотоксичностью, отмечается не только при болезни Альцгеймера, но и при других состояниях, например, при болезни Паркинсона и рассеянном склерозе. Препарат под названием Мемантин, изначально применявшийся при лечении гриппа, ингибирует активацию глутаматных NMDA-рецепторов. Показана умеренная эффективность мемантина при болезни Альцгеймера умеренной и сильной тяжести, но неизвестно, как он действует на ранней стадии. Редко отмечаются слабовыраженные побочные эффекты, среди них — галлюцинации, замешательство, головокружение, головная боль и утомление. В комбинации с донепезилом мемантин демонстрирует «статистически значимую, но клинически едва заметную эффективность» в действии на когнитивные показатели.
У пациентов, чьё поведение представляет проблему, антипсихотики могут в умеренной степени снизить агрессию и воздействовать на психоз. В то же время эти препараты вызывают серьёзные побочные эффекты, в частности, цереброваскулярные осложнения, двигательные нарушения и снижение когнитивных способностей, что исключает их повседневное использование. При длительном назначении антипсихотиков при болезни Альцгеймера отмечается повышенная смертность.
Психосоциальное вмешательство
«Сенсорная интегративная терапия»: специальная сенсорная комната (англ. snoezelen) используется для эмоционально-ориентированной помощи людям, страдающим от деменции.
Психосоциальное вмешательство дополняет фармакологическое и может быть подразделено на следующие подходы
· поведенческие
· эмоциональные
· когнитивные
· стимуляторно-ориентированные
Эффективность вмешательства пока не освещена в научной литературе, к тому же сам подход распространяется не на болезнь Альцгеймера, а на деменцию в целом.
Поведенческое вмешательство нацелено на определение предпосылок и последствий проблемного поведения и работу по их коррекции. При использовании этого подхода не отмечено улучшения общего уровня функционирования, но возможно смягчение некоторых отдельных проблем, таких как недержание мочи. Относительно воздействия методик этого направления на другие поведенческие отклонения, такие как блуждание, не накоплено достаточно качественных данных.
Вмешательства, затрагивающие эмоциональную сферу, включают в себя терапию воспоминаниями (reminiscence therapy, RT), валидационную терапию, поддерживающую психотерапию, сенсорную интеграцию («снузелен»), и «симуляцию присутствия» (англ. simulated presence therapy, SPT). Поддерживающая психотерапия почти не исследовалась научными методами, но некоторые клинические работники считают, что она даёт пользу при попытке помочь легкобольным пациентам адаптироваться к заболеванию. При терапии воспоминаниями (RT) пациенты обсуждают пережитые ими события с глазу на глаз с терапевтом либо в группе, зачастую с использованием фотографий, предметов домашнего обихода, старых музыкальных и архивных аудиозаписей и других знакомых предметов из прошлого. Хотя число качественных исследований эффективности RT невелико, возможно положительное воздействие этого метода на мышление и настрой пациента. Симуляция присутствия, основанная на теориях привязанности, подразумевает проигрывание аудиозаписей с голосами ближайших родственников. По предварительным данным, у пациентов, проходящих курс SPT, снижается уровень тревожности, поведение становится более спокойным. Валидационная терапия основана на признании реальности и персональной правды переживаний другого человека, а на сеансах сенсорной интеграции пациент выполняет упражнения, призванные стимулировать органы чувств. Данных в поддержку этих двух методов немного.
Ориентирование в реальности, когнитивная переподготовка и другие когнитивно-ориентированные методы терапии применяются с целью снизить когнитивный дефицит. Ориентирование в реальности заключается в представлении информации о времени, местоположении и личности пациента для того, чтобы облегчить осознание им обстановки и собственного места в ней. В свою очередь, когнитивная переподготовка проводится для улучшения нарушенных способностей больного, которому задают задачи, требующие умственного напряжения. Отмечено некоторое улучшение когнитивных возможностей при использовании как первого, так и второго метода, однако в некоторых исследованиях этот эффект со временем исчезал и были отмечены негативные проявления, например, разочарование пациентов.
Стимулирующие методы терапии включают арт-терапию, музыкотерапию, а также разновидности терапии, при которых пациенты общаются с животными, занимаются физическими упражнениями и любой другой общеукрепляющей активностью. Стимуляция, по данным исследований, в умеренной степени влияет на поведение и настроение, и ещё меньше на уровень функционирования. Как бы то ни было, такая терапия проводится в основном для улучшения повседневной жизни пациентов.
Уход и присмотр
Уход и присмотр за пациентом крайне важен из-за неизлечимости и дегенеративного характера болезни. Эту роль часто берёт на себя супруг или близкий родственник. Столь тяжёлая ноша сильно отражается на социальной, психологической, экономической и других сторонах жизни человека, занятого уходом за больным.
Поскольку болезнь Альцгеймера неизлечима и постепенно сводит на нет способности человека заботиться о себе, уход за больным фактически составляет основу терапии и заслуживает особого внимания на всём протяжении болезни.
На ранней и умеренной стадиях болезни можно повысить безопасность пациента и облегчить тяжесть ухода за ним, внося изменения в обстановку и образ жизни. Среди таких мер — переход к простому рутинному распорядку дня, навешивание предохранительных замков, ярлыков на домашние принадлежности с пояснением, как их использовать. Пациент может потерять способность самостоятельно питаться, в таком случае нужно измельчать пищу или переводить её в кашеобразное состояние. При возникновении проблем с проглатыванием пищи может потребоваться кормление через трубку. В таком случае перед членами семьи и обслуживающими работниками встаёт этический вопрос о том, как долго следует продолжать кормление, насколько это эффективно с медицинской точки зрения. Необходимость физически фиксировать пациента возникает редко, однако в некоторых ситуациях приходится прибегать к фиксации, чтобы уберечь больного от причинения вреда себе или окружающим.
По мере развития болезни могут возникать различные осложнения, например, заболевания зубов и полости рта, пролежни, нарушения питания, гигиенические проблемы, респираторные, глазные или кожные инфекции. Их можно избежать при тщательном уходе, но при их возникновении требуется профессиональное вмешательство. Облегчение самочувствия пациента перед приближающейся смертью становится основной задачей на последней стадии болезн.
Уход за больным
Основную заботу о пациенте обычно берёт на себя супруг или близкий родственник, тем самым взваливая на себя тяжелую ношу, поскольку уход требует физической нагрузки, финансовых затрат, отражается на социальной стороне жизни и психологически очень тягостен. И пациенты, и родственники обычно предпочитают уход на дому. При этом возможно отложить либо вовсе избежать необходимости в более профессиональном и дорогостоящем уходе, однако две трети жильцов в домах престарелых всё же страдают от деменции.
Среди лиц, заботящихся о дементном больном, отмечается высокий уровень соматических заболеваний и расстройств психики. Если они живут под одной крышей с больным, если больной — супруг или супруга, если больной впадает в депрессию, ведет себя неадекватно, галлюцинирует, страдает от нарушений сна и не в состоянии нормально передвигаться — все эти факторы, по данным исследований, связаны с повышенным числом психосоциальных проблем. Заботящийся о больном также вынужден проводить с ним в среднем 47 часов в неделю, зачастую за счёт рабочего времени, при этом затраты на уход высоки. Прямые и косвенные расходы по уходу за пациентом в США составляют в среднем от 18000$ до 77500$ в год, по данным разных исследований.
По данным исследований, психологическое здоровье лиц, заботящихся о больных, можно укрепить методами когнитивной поведенческой терапии и обучениемстратегиям противодействия стрессу, как индивидуально, так и в группах.
Прогноз
На ранних стадиях болезнь Альцгеймера плохо поддаётся диагностике. Определённый диагноз обычно ставится, когда когнитивные нарушения начинают отражаться на повседневной активности человека, хотя сам больной может быть ещё способен жить независимой жизнью. Постепенно лёгкие проблемы в когнитивной сфере сменяются нарастающими отклонениями, как когнитивными, так и иными, и этот процесс неумолимо переводит человека в зависимое от чужой помощи состояние.
Продолжительность жизни в группе больных снижена, а после постановки диагноза они живут в среднем около семи лет. Менее 3 % пациентов остаются в живых более четырнадцати лет. С повышенной смертностью ассоциированы такие признаки, как повышенная тяжесть когнитивных нарушений, сниженный уровень функционирования, падения, отклонения при неврологическом осмотре. Другие сопутствующие нарушения, например, кардиологические проблемы, диабет, историязлоупотреблений алкоголем, также связаны со сниженным выживанием. Чем раньше началась болезнь Альцгеймера, тем больше лет в среднем удаётся прожить пациенту после диагноза, но при сравнении со здоровыми людьми общая продолжительность жизни такого человека особенно низка. Прогноз по выживаемости у женщин более благоприятен, чем у мужчин.
Смертность у пациентов в 70 % случаев обусловлена самой болезнью, при этом чаще всего непосредственными причинами являются пневмония и обезвоживание организма. Рак при болезни Альцгеймера отмечается реже, чем в общей популяции.
Нагрузка на общество
Среди болезней, налагающих большую нагрузку на общество в развитых странах, болезнь Альцгеймера и деменция в целом могут занимать одно из первых мест. В развивающихся странах, таких как Аргентина[, и новых развитых странах общественные затраты также высоки и продолжают расти. Вероятно, они поднимутся ещё выше по мере старения общества и станут важной социальной проблемой. В число затрат входят прямые медицинские расходы на содержание домов престарелых и немедицинские — на домашний уход за больным, и косвенные расходы, например, потеря производительности — как пациента, так и человека, заботящегося о нём. Приводимые в исследованиях оценки разнятся, но в целом по всему миру затраты на деменцию могут составлять около 160 млрд долл., а в США — около 100 млрд долл. ежегодно.
Самые большие общественные затраты идут на оплату долговременного профессионального ухода за больным, в частности, институционализацию, на это требуется до двух третей от всего объёма средств. Уход на дому также обходится дорого, особенно при учёте неформальных семейных расходов, в том числе уделяемого времени и потерянной заработной платы.
Затраты возрастают при тяжёлой деменции и нарушениях поведения в связи с необходимостью уделять больше времени на уход за больным. Следовательно, любая терапия, способная замедлить угасание когнитивных способностей, отодвинуть институционализацию или уменьшить число часов, уделяемых на уход за больным, будет полезна с экономической стороны. Экономическая оценка существующих методик терапии говорит о положительных результатах.
Литература
· Ю. Г. Каминский, Е. А. Косенко «Популярно и не очень о болезни Альцгеймера» Либроком, 2009 г., 136 стр. ISBN 978-5-397-00194-6
· Билл Грант «Старческое слабоумие. Болезнь Альцгеймера и другие формы.» Alzheimer’s Disease. A Carer’s Guide Серия: Советы врача Норинт, 2003 г., 80 стр. ISBN 5-7711-0161-3
· В Барселоне изобретена вакцина против болезни Альцгеймера — материал из Викиновостей.
· «Современные представления о болезни Альцгеймера»
· «Нейрофибриллярные клубки при болезни Альцгеймера — не убийцы, а защитники клеток?»