Вопрос о донорстве органов
Каждый человек вправе решить, что будет с его телом после смерти. Например, он может пожертвовать свое тело науке, для медицинских исследований, или стать донором. Если у человека есть паспорт донора, то это означает, что в случае его смерти, здоровые органы могут быть изъяты для пересадки.
МЕДИЦИНСКОЕ СВИДЕТЕЛЬСТВО О СМЕРТИ
Медицинское свидетельство о смерти – это не только медицинский документ, удостоверяющий факт смерти для регистрации в органах ЗАГС, но и важный статистический документ, являющийся основой государственной статистики причин смерти. В настоящее время используется рекомендованное Всемирной ассамблеей здравоохранения «Медицинское свидетельство о смерти» (форма № 106/у-98). Этот документ оформляется на всех умерших в возрасте 168 часов после рождения и старше. Медицинское свидетельство о смерти имеет 19 пунктов и выдается с пометкой «окончательное», «предварительное», «взамен предварительного». В пункте 16 свидетельства следует подчеркнуть, каким медицинским работником установлена причина смерти: 1 – врачом, только установившим смерть, 2 – врачом, лечившим умершего, 3 – фельдшером, 4 – патологоанатомом, 5 – судмедэкспертом. В пункте 17 отражено основание для определения патологических процессов (состояний), приведших к смерти, и установления ее причины: 1 – осмотр трупа, 2 – записи в медицинской документации, 3 – предшествующее наблюдение, 4 – вскрытие. Причина смерти записывается в двух частях пункта 18 свидетельства. В I части этого пункта указывается цепь событий, непосредственно приведших к смерти, а во II части – прочие важные состояния, но не связанные с перечнем, указанным в первой части.
Первая часть свидетельства имеет 4 строки, в каждой из которых записывается только одно заболевание (состояние), имеющееся в рубриках МКБ и принятых классификациях:
I. а) непосредственная причина смерти (как правило, главное осложнение); б) «промежуточная» причина смерти (предшествующая непосредственной); в) первоначальная причина смерти (основное заболевание, подлежащее кодированию); г) внешние причины (при травмах и отравлениях).
II. Прочие важные заболевания (патологические процессы), но не связанные с основным заболеванием. Подпункт «г» при смерти от болезней используется редко и кодируется дополнительно.
В медицинскую статистику кодируется последняя запись в перечне «а, б, в», то есть «в», если заполнены все три строки. Как видно, она должна соответствовать тому заболеванию, которое в посмертном или патологоанатомическом диагнозе стоит на 1-м месте (основное).
Особенность записи в пункт 18 медицинского свидетельства в виде цепи, обратной посмертному диагнозу, сложилась исторически, и ее надо просто запомнить. Требования к оформлению диагнозов при летальных исходах должны точно соответствовать действующей МКБ, при этом для статистического учета требуется только первоначальная причина смерти. Запись причины смерти может закончиться строкой «а», если основное заболевание непосредственно само вызвало смерть (например, смерть от менингококкового менингита, от кровоизлияния в ствол мозга). При этом в строке «а» не принято записывать признаки механизма смерти, такие как сердечная или дыхательная недостаточность, асистолия, во-первых, потому что механизмы смерти универсальны и для понимания непосредственной причины смерти ничего не дают, во-вторых, чтобы сохранить строки для более важных характеристик. Если для убедительности записи достаточно заполнить две строки, то запись заканчивается строкой «б» (кодируется «б»):
I. а) гипергликемическая кома;
б) сахарный диабет.
Если цепь событий состоит из трех или боле последовательных процессов, то нужно выбрать самые убедительные три, этого будет достаточно, для выбора «первопричины» (кодируется «в»):
I. а) гипергликемическая кома
б) вторичный сахарный диабет
в) рак тела и хвоста поджелудочной железы
I. а) уремия
б) хронический восходящий пиелонефрит
в) гиперплазия предстательной железы
Запись свидетельства при смерти, обусловленной формами в группах ИБС, ЦВБ, СПК, сохраняет принятые исключения из правил и получается более упрощенной, причем групповые аббревиатуры в медицинское свидетельство не записываются (в данном примере кодируется «а»):
I. а) острый передний инфаркт миокарда
II. Стенозирующий атеросклероз коронарных артерий
Однако при инфаркте миокарда другого происхождения запись будет патогенетической (в данном примере кодируется «в»):
I. а) инфаркт миокарда
б) прорастание опухоли в перикард
в) центральный рак бифуркации трахеи и легких
При инсульте, обусловленном гипертонической болезнью или атеросклерозом, – ЦВБ (в данных примерах кодируется «а»):
I. а) кровоизлияние в головной мозг
II. Гипертоническая болезнь
I. а) ишемический инсульт (инфаркт) головного мозга
II. Атеросклероз мозговых артерий
Однако при инсульте другого происхождения запись будет патогенетической (в данных примерах соответственно кодируются «б» и «в»):
I. а) кровоизлияние в головной мозг
б) миелоидный лейкоз с поражением сосудов мозга
I. а) ишемический инсульт (инфаркт) головного мозга
б) тромбоз мозговой артерии
в) височный артериит
Во вторую часть бланка можно вписать не более двух важных из сопутствующих или комбинированных основных заболеваний (конкурирующее, фоновое, сочетанное), они подлежат отдельной кодировке, которую выполняют медицинские статистики. Код основного заболевания (первоначальной причины смерти), согласно приказу № 398 от 1996 г., должен найти в МКБ и поставить в «сетку» справа от записи сам врач, заполняющий медицинское свидетельство о смерти.
При заполнении свидетельства на умершую беременную, роженицу, родильницу записи рекомендуется делать в следующем порядке:
В случае смерти в результате акушерских осложнений беременности, родов или послеродового периода, а также в результате вмешательства, неправильного ведения родов и т.д. запись должна четко указывать на связь с беременностью, родами, послеродовым периодом (здесь кодируется «в»):
I. а) острая почечная недостаточность
б) некротический нефроз
в) нефропатия III степени в сроке беременности 36 недель
II. Операция кесарева сечения. Послеродовой период 3 день
В случае смерти беременной, роженицы или родильницы в результате существовавшей прежде у нее болезни, возникшей или обострившейся в период беременности, но не связанной с ней, в подпункты «а», «б», «в» делается запись о заболевании, приведшем к смерти, а во вторую часть – запись о сроке беременности или какой день после родов (здесь кодируется «б»):
I. а) легочно-сердечная недостаточность
б) хронический милиарный туберкулез легких
в) –
II. Операция кесарева сечения в сроке беременности 34 недели.
Пункт 19 свидетельства содержит уточняющие положения о связи смерти с родами или беременностью (смерть наступила в течение беременности или до 42 дней после ее прекращения, или смерть наступила с 34 по 365 день после родов).
Лекции
№ 6. Патология, связанная с факторами окружающей среды.
№ 7. Алкогольная интоксикация и алкоголизм.
№ 8. Наркомания, токсикомания.
№ 9. Неблагоприятные последствия диагностики и лечения.
Краткий конспект
Природа неблагоприятных факторов окружающей среды.
Ксенобиотики. Природа неблагоприятных факторов окружающей среды, приводящих к развитию патологических процессов у человека, может быть различной — химической и физической. Химические чужеродные факторы называются ксенобиотиками. Ксенобиотики (гр.xenos чужой + bios жизнь) — чужеродные для организма соединения (пестициды, препараты бытовой химии, лекарственные средства и т.п.), которые, попадая в окружающую среду в значительных количествах, могут вызвать гибель организма, нарушить нормальное течение природных процессов в биосфере. Ксенобиотики могут попадать в организм человека в результате профессиональной деятельности (асбест, пестициды, радионуклиды и др.), в связи с наличием вредных привычек (наркотики, табачный дым, алкоголь), а также при использовании некоторых лекарственных средств или при наличии индивидуальной реакции на них.
На протяжении эволюции главными воротами проникновения в организм чужеродных агентов были и остаются легкие, желудочно-кишечный тракт и кожа, обладающие мощными барьерными системами. Однако в современных неблагоприятных экологических условиях данные барьерные системы оказываются несостоятельными, происходит срыв процессов адаптации, что приводит к развитию многих заболеваний. Кроме того, существует ряд индивидуумов с изначально несостоятельными барьерными системами (врожденные и приобретенные иммунодефициты, пигментная ксеродерма, муковисцидоз, синдром Картагенера и др.), что лежит в основе развития хронического воспаления и даже опухолевого роста.
Механизмы токсического действия неблагоприятных факторов внешней среды. Взаимодействие яда с организмом изучается в двух аспектах: как влияет вещество на организм и что происходит с веществом в организме. На первый вопрос можно ответить при изучении токсикодинамики, а на второй — токсикокинетики вещества, что является предметом изучения токсикологии. Именно поэтому в основе общей токсикологии лежит учение о движении токсических веществ в организме: пути их поступления, распределения, метаболическое превращение (биотрансформация) и выведения. Патологическое состояние, развивающееся вследствие взаимодействия яда и организма, называется интоксикацией, или отравлением.
В соответствии с принятой в России терминологией отравлением обычно называют только те интоксикации, которые вызваны "экзогенными"ядами, поступившими в организм извне.
Принимая во внимание большое значение количественного фактора как одного из непременных условий развития отравления, второй не менее важной задачей токсикологии является определение зоны токсического действия изучаемого химического вещества (токсикометрия).
Основными параметрами токсикометрии являются:
Limac — порог однократного (острого) действия токсического вещества — минимальная пороговая доза, вызывающая изменения показателей жизнедеятельности организма, выходящие за пределы приспособительных реакций;
DL50 (DL100) — среднесмертельная (смертельная) доза, вызывающая гибель 50% (100%) подопытных животных при определенном способе введения (в желудок, на кожу и пр.) и двухнедельном сроке последующего наблюдения. Выражается в миллиграммах вещества на 1кг массы тела животного (мг/кг);
CL50 (CL100) — это концентрация (доза), вызывающая гибель 50% (100%) подопытных животных при ингаляционном воздействии, выражается в миллиграммах на 1 м воздуха;
ПДК — предельно допустимая концентрация вещества в воздухе, выражается в миллиграммах на 1 м воздуха;
ОБУВ — ориентировочный безопасный уровень воздействия вещества, выражается в миллиграммах на 1 м воздуха.
Токсическую опасность химического вещества характеризуют также величиной зоны острого токсического действия: DL50/ Limac .
При оценке возможных последствий контакта человека с ксенобиотиками следует определить органы-мишени их действия, для чего необходимо принимать во внимание следующие факты:
• во-первых, после прохождения барьерных систем ксенобиотики могут концентрироваться в определенных органах и тканях;
• во-вторых, в результате превращения в организме ксенобиотиков могут образовываться продукты, обладающие более высокой токсичностью и способные вступать во взаимодействие с определенными компонентами клеток и тканей, что может приводить к токсическому эффекту;
• в-третьих, токсический эффект проявляется там, где происходит метаболизм или экскреция токсического продукта;
• в-четвертых, токсическая опасность чужеродного вещества определяется не только его DL, но и Limac.
Для того чтобы понять механизм токсического эффекта чужеродных агентов, необходимо остановиться на особенностях метаболизма ксенобиотиков, которые связаны со следующими характеристиками:
• большинство ксенобиотиков обладают липофильностью, что позволяет им легко проникать в кровоток и преодолевать клеточные мембраны;
• имеется генетически детерминированная индивидуальность в активности ферментов, принимающих участие в метаболизме ксенобиотиков, например цитохром Р-450 монооксигеназной зависимой системы;
• существует несколько различных путей метаболизма токсических веществ. Преобладание определенных путей метаболизма токсических веществ над другими определяет их токсичность и канцерогенность;
• метаболизм ксенобиотиков в организме зависим от гормонального статуса и особенностей общего обмена веществ в организме;
• ряд экзогенных факторов, таких как этанол, лекарственные вещества и др. могут усиливать или подавлять активность ферментов, участвующих в метаболизме ксенобиотиков;
• существуют метаболические механизмы, способные модифицировать взаимодействие активных метаболитов и молекул-мишеней;
• липофильные ксенобиотики метаболизируются в организме в гидрофильные вещества благодаря присоединению полярных функциональных групп и конъюгации с эндогенными молекулами.
Этапы метаболизма ксенобиотиков в организме. 1-я фаза биотрансформации с образованием метаболитов включает метаболизирование ксенобиотиков в клетке и превращение их в гидрофильные субстанции, что обеспечивается работой нескольких окислительно-восстановительных ферментных систем и реакциями гидролиза. Основными системами реакций 1-го этапа являются: цитохром Р-450 монооксигеназно зависимая система, флавинсодержащая монооксигеназная система, система перекисного окисления и простагландин Н синтетаза.
Цитохром Р-450монооксигеназно зависимая система располагается в гладком эндоцитоплазматическом ретикулуме и состоит из комплекса ферментов: Р-450, NADPH-P-450 редуктазы и фосфатидилхолина. Наивысшей активностью данная цитохром Р-450 монооксигеназно зависимая система обладает в клетках печени. Существуют тканеспецифические изоформы Р-450, что обеспечивает избирательность синтеза некоторых веществ в определенных тканях, а следовательно, и специфичность органопатологии. Важнейшим ксенобиотиком, канцерогенным агентом, метаболизирующимся данной системой и присутствующим в табачном дыме, является бензопирен. При метаболизме бензопирена в легких и коже образуются гидрофильные соединения, способные связываться с ДНК, что обусловливает его канцерогенный эффект.
Флавин содержащая монооксигеназная система также расположена в гладком эндоплазматическом ретикулуме гепатоцитов. Данная система участвует в окислении никотина и других аминов, поступающих в легкие.
Система перекисного окисления и простагландин Н синтетаза расположены в гладком эндоплазматическом ретикулуме семенных пузырьков, клетках почек и мочевого пузыря. Данные ферменты метаболизируют 2-нафтиламин — канцерогенный агент, вызывающий рак мочевого пузыря.
В окислительных реакциях 1-го этапа образуются активные кислородные радикалы и токсические метаболиты ксенобиотиков, способные взаимодействовать с эндогенными продуктами, и выводиться из организма, превращаясь в водорастворимые соединения.
Защитные механизмы 1-го этапа метаболизирования токсических продуктов связаны с продукцией в клетках глютатиона, осуществляющего нейтрализацию активных кислородных радикалов, перекисей липидов и токсических форм ксенобиотиков.
2-я фаза конъюгации и метаболизирования ксенобиотиков может происходить по трем путям: глюкуронизации, метилирования и соединения с глютатионом.
Глюкуронизация с образованием глюкуронидов. Примером может служить производство органических красителей, когда работники подвержены воздействию высоких концентраций нафтиламина. В организме человека происходит соединение нафтиламина с глюкуроновой кислотой с экскрецией продукта, обладающего канцерогенными свойствами, с мочой, что может приводить к развитию рака мочевого пузыря.
Патология, вызванная неблагоприятными факторами внешней среды, попадаемыми при дыхании.
В наши дни структура заболеваний, вызванных неблагоприятными факторами внешней среды, претерпела значительные изменения в связи с проявлением различных путей поступления ксенобиотиков в организм человека. В ходе эволюции основная масса токсических продуктов поступала в организм через желудочно-кишечный тракт и обезвреживалась в печени. В настоящее время основная доля чужеродных продуктов поступает в организм человека через легкие, что обусловлено увеличением их концентраций в атмосферном воздухе, а также гигантскими размерами аэрогематического барьера (80 м при выдохе и 120 м при вдохе), представляющего собой самую большую мембрану организма на границе с внешней средой, защита которой обеспечивается комплексом механизмов бронхо-легочной защиты. Кроме того, имеются указания на то, что человек более чувствителен в токсическим веществам, поступающим через легкие, чем через желудочно-кишечный тракт: ПДК одного и того же вещества в воде и в атмосферном воздухе различны.
Становится понятным повышение распространенности дыхательной патологии в наши дни: хронических обструктивных болезней, бронхиальной астмы, интерстициальных болезней легких, рака легкого. Это привело к возникновению нового раздела пульмонологии — "Экологической пульмонологии". Экологическая пульмонология — раздел легочной патологии, изучающий заболевания респираторных органов, вызываемых химическими и физическими факторами природного, техногенного и бытового происхождения (Величковский Б.Т., 2001).
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов легкого и осуществляются путем кондиционирования воздуха, механической очистки, эндоцитоза бронхиальным эпителием, гуморальной неспецифической защиты, клеточной неспецифической защиты, иммунной специфической защиты.
Кондиционирование воздуха связано с его обогревом или охлаждением, увлажнением в верхних дыхательных путях и в крупных бронхах. Механическая очистка воздуха начинается с его фильтрации при прохождении полости носа. При этом происходит осаждение ингалированных частиц на слизистых оболочках носа, трахеи и бронхов с последующим удалением их при чихании и кашле. Осаждение частиц зависит от их диаметра. Так, в носовой полости задерживаются частицы диаметром более 50 мкм, трахее — 30—50 мкм, в бронхах — 10—30 мкм, в бронхиолах — 3—10 мкм, в альвеолах — 1—3 мкм. Частицы, диаметр которых меньше 0,5 мкм, в легких практически не задерживаются.
Наиболее важную часть механической очистки воздуха от микроорганизмов и других повреждающих агентов составляет мукоцилиарный клиренс, действующий на уровне бронхов и бронхиол.
Он обеспечивается выработкой слизистого секрета слизистыми железами бронхов, бокаловидными клетками и клетками Клара покровного эпителия, а также биением ресничек реснитчатых клеток. В состав слизистого секрета, помимо слизи, входят различные гликопротеины, протеазы, сурфактант, IgA. Слизистый покров имеет толщину 5—7 мкм и разделен на два слоя: на уровне ресничек он представлен жидкой фазой (золем), что обеспечивает благоприятные условия для их движения, на поверхности эпителия — плотной фазой (гелем). Функционирование мукоцилиарной системы связано с задержкой вдыхаемых частиц слизью с последующим перемещением их за счет биения ресничек по направлению к трахее и удалением их при кашлевом рефлексе.
Известно множество состояний, при которых происходит повреждение мукоцилиарного клиренса, способствующее развитию острых пневмоний: первичная цилиарная дискинезия (синдром Картагенера), холодный или горячий воздух, наркотические препараты, табачный дым, аллергены, медленно реагирующая субстанция анафилаксии, ПГЕ1, ПГЕ2 и лейкотриен (ускоряют биение ресничек).
Неспецифические защитные факторы продуцируются в основном полиморфноядерными лейкоцитами и макрофагами, постоянно присутствующими в дыхательных путях, а также серозными клетками желез: интерферон, лизоцим, лактоферрин, протеазы, антипротеазы, секреторный иммуноглобулин и др.
Клеточные механизмы неспецифической защиты легочной ткани наибольшее значение имеют в ее респираторных отделах, где нет мукоцилиарной системы и секрета, содержащего гуморальные факторы неспецифической защиты. Важнейшими клетками этой системы являются альвеолярный макрофаг, полиморфноядерный лейкоцит, лаброцит и эозинофил.
Иммунные механизмы специфической защиты бронхов и легочной паренхимы осуществляются лимфоидными и макрофагальными клетками бронхоассоциированной лимфоидной ткани и лимфатических узлов. Особое значение имеет секреция IgA и IgG. IgA в большом количестве содержится в секрете и защищает легкие от вирусной инфекции, обеспечивает агглютинацию бактерий и нейтрализацию их токсинов. IgG сыворотки и нижних отделов дыхательных путей агглютинирует и опсонизирует бактерии, активирует комплемент, ускоряя хемотаксис гранулоцитов и макрофагов, нейтрализует бактериальные токсины и вирусы, лизирует грамотрицательные бактерии.
Все перечисленные механизмы защиты обеспечивают дренажную функцию бронхов, при нарушении которой возникают благоприятные условия для развития острых пневмоний.
Профессиональные заболевания легких.
Профессиональные заболевания легких обозначаются термином пневмокониозы. Пневмокониоз (гр.pneumon легкое + konia пыль) — профессиональное заболевание, обусловленное вдыханием запыленного воздуха.
Классификация пнвмокониозов в настоящее время претерпела изменения и включает три группы заболеваний:
• пылевой фиброз легких от воздействия фиброгенной пыли;
• интерстициальные болезни легких от воздействия органических пылей (см. лекции по патологии легких);
• хронический пылевой бронхит;
• хронические обструктивные болезни легких (см. лекции по патологии легких).
Пылевой фиброз легких от воздействий фиброгенной пыли послужил основой для выделения группы пневмокониоза, которая включает: силикоз (от пыли кремнезема), асбестоз (от пыли асбеста), антракоз (от пыли ископаемых углей), бериллиоз (от пыли соединений бериллия) и др.
Фиброгенная пыль, не растворимая в жидких средах организма, попадая в легкие, оказывает свое патологическое воздействие путем индукции образования активных форм кислорода с последующим развитием аутоиммунных реакций, заканчивающихся фиброзом легкого.
Инициальным механизмом воздействия фиброгенной пыли на легкие является избыточное образование активных форм кислорода, в основном альвеолярными макрофагами и полиморфноядерными лейкоцитами. При этом установлено, что в зависимости от химической природы пылевой частицы имеются особенности генерации разных форм активного кислорода и липидных перекисей. Количество гидроксильных радикалов в присутствии частиц кварца увеличивается на 18%, а асбеста — на 63%, т.е. в три раза больше. Это приводит к тому, что профиль активных форм кислорода при разных видах пневмокониозов неодинаков: при силикозе преобладают супероксидный анион-радикал и перекись водорода, при асбестозе — гидроксильные радикалы и липидные перекиси, при антракозе и других пневокониозах, обусловленных низкоцитотоксичными аэрозолями — супероксидный анион-радикал.
Фагоцитоз пылевых частиц губителен для макрофага — кониофага, поскольку генерация активных форм кислорода не приводит к перевариванию частиц, которые к ним не чувствительны, а образующиеся радикалы разрушают сам макрофаг и окружающие ткани легкого.
Активация фибробластов происходит параллельно с активацией макрофагов, при этом последние являются основными генераторами субстанций, потенциирующих фиброз (интерлейкина-1, фибронектина, фактора роста фибробластов, транформирующего фактора роста — бета и др.).
Морфологические изменения в легких при пневмокониозах могут быть двух типов: диффузный интерстициальный фиброз и гранулематозный процесс. Полагают, что тип тканевой реакции в легких обусловлен характером аутоиммунного процесса. Аутоиммунный ответ является результатом повреждения и модификации собственных белков организма под действием активных форм кислорода и липидных перекисей.
При воздействии пылевых частиц с выраженной каталитической способностью (асбест, оксид цинка) происходит образование гидроксильного радикала, и патологический процесс становится подобным фиброзирующему альвеолиту с развитием сотового легкого.
При воздействии двуокиси кремния происходит активация генерации активных форм кислорода и медиаторов липоксигеназного и циклоксигеназного путей макрофагами, развитие гиперчувствительности замедленного типа с образованием гранулем.
Низкоцитотоксические пыли (угольная пыль) приводят к незначительным тканевым повреждениям, видимо, не сопровождающимся аутоиммунизацией.
Патология, вызванная вредными привычками.
Курение табака. Курение табака относится к вредным привычкам и приводит к значительным неблагоприятным последствиям в бронхолегочной системе. Оно является одним из основных факторов обструктивных заболеваний легких, рака легкого, а также гранулематоза из клеток Лангерганса. Курение табака усугубляет течение практически всех заболеваний легкого, поскольку вызывает развитие обструктивного компонента за счет развития хронического обструктивного бронхита курильщиков. Миллионы курящих людей наносит вред не только себе, но и окружающим их пассивным курильщикам. По сравнению с сигаретами и папиросами курение трубки или сигар менее вредно, но, разумеется, несет тот же риск, "реализация" которого может быть лишь оттянута по времени. Нюханье, вдыхание и жевание табака тоже влияет на повышение частоты рака ротовой полости и верхних дыхательных путей.
Хронический бронхит курильщиков характеризуется развитием обструктивного компонента с гиперпродукцией слизи, накоплением в легочной ткани характерных макрофагов — "клеток курильщиков", содержащих в цитоплазме пылевые включения, а также развитием плоскоклеточной метаплазии и дисплазии бронхиального эпителия, которые после 15 лет курения могут малигнизироваться и привести к развитию бронхогенного рака легкого (см. лекцию по патологии легких).
В табачном дыме содержится до 40 хорошо известных канцерогенов (полициклические углеводороды, бетанафти ламин, нитрозамины), раздражающие вещества и токсины (аммиак, формальдегид, окислы азота и др.), окись углерода и никотин. Все они действуют на симпатическую нервную систему, кровяное давление, частоту сердечных сокращений и прочие системы и функции.
Среднестатистический курильщик, выкуривающий за 1 день пачку сигарет, "втягивает" в свои органы дыхания смесь вредных продуктов примерно 70 000 раз в год. Причиной смерти номер 1, связанной с курением сигарет, является ишемическая (коронарогенная) болезнь сердца, в частности инфаркт миокарда. От инфаркта погибают более 20% лиц среди умирающих от каких-либо болезней сердца. Следующей очень близкой по частоте причиной смерти курильщиков является бронхогенный рак легкого. Сигаретный дым — фактор риска для хронических обструктивных поражений легких (хронический бронхит, эмфизема), а также для рака других органов. Примерно 30% всех смертей от злокачественных новообразований в США связаны с курением, и почти все из более чем 140 тыс. американцев, умирающих каждый год от рака легкого, — курильщики. Известна также зависимость уровня смертности от доз табачного дыма. В последние 20 лет женщины стали "догонять" мужчин и по зависимости от табачного зелья, и заболеваемости, связанной с курением.
Известно, что продукты сгорания табака оказывают вредоносное действие на плод, а также новорожденных и детей младшего возраста. Во многих исследованиях, посвященных этой проблеме, показана высокая частота недоношенности, преждевременных родов, спонтанных абортов, мертворожденности и младенческой смертности, а также осложнений беременности, таких как отслойка плаценты, предлежащая плацента, преждевременное вскрытие плодного пузыря. Курение способствует снижению физического и умственного развития плода и новорожденного.
Пассивное курение. Вынужденное вдыхание табачного дыма некурящими лицами, находящимися в одном помещении с курящим(и), вредно для здоровья. Такая ситуация получила название пассивного курения. Эффект воздействия в этом случае зависит от многих факторов: уровня вентиляции и объема помещения, количества табачного дыма, продолжительности контакта с дымом. Например, сильному воздействию подвергаются дети, матери которых курят. Доказано, что относительный риск возникновения бронхогенного рака легкого для пассивных курильщиков равен 1,5. Кроме того, такие лица чаще, чем обычные люди, имеют сердечнососудистую патологию. А у детей курящих родителей отмечено повышение частоты респираторных заболеваний. Есть данные о пагубном влиянии пассивного курения на физическое и умственное развитие младенцев.
Алкоголизм.
Алкоголизм может быть определен как экзогенная интоксикация, связанная со злоупотреблением этанола (этилового спирта, винного спирта, алкоголя). Винный спирт впервые получили в арабских странах в VI—VII вв. и назвали его "аль кегль", что означает "одурманивающий". В России алкоголизм широко распространен и представляет собой государственную проблему. В Европе этиловый спирт согласно легенде был выделен монахом алхимиком Валентинусом, назвавшим его "водой жизни".
Механизм воздействия этанола связан с повреждающим действием на клетки этанола и его метаболитов (ацетальдегида и др.). Сопутствующая недостаточность питания (например, авитаминозы) рассматривается как основа для большинства патологических процессов, возникающих при хроническом алкоголизме.
Попав в организм, этанол претерпевает две фазы изменений: резорбции и элиминации. После приема через рот он легко всасывается в желудке (20%) и в кишечнике (80%). Максимальная концентрация в крови достигается уже через 1,5 ч после его приема. При этом в наибольшей степени алкоголь концентрируется в органах с интенсивным кровообращением (головной мозг, печень, почки).
Основная часть этилового спирта метаболизируется в печени одним из трех способов. 90% алкоголя метаболизируется с помощью алкогольдегидрогеназы, катализирующей образование ацетальдегида, который быстро превращается в ацетат.
При втором, несомненно, часто встречающемся способе метаболизма, используется печеночная микросомная система Х-450, тоже мобилизуемая на детоксикацию различных веществ. В этом случае вновь образуется ацетальдегид, окисляемый в ацетат. У взрослых лиц, имеющих средние рост и массу тела, оба пути метаболизма возникают от одного глотка этанола (10 г) в 1 ч. При третьем, более редком способе метаболизма спиртных продуктов, важную роль играет пероксисомная каталаза (пероксисомы — специализированные окислительные микротельца в гепатоцитах, содержащие ряд ферментов).
Алкоголизм может развиться остро и протекать хронически. При остром алкоголизме поражается центральная нервная система, могут быстро возникать обратимые изменения в желудке и печени (см. лекцию "Болезни печени"). В зависимости от дозы алкоголя в крови развиваются различные состояния: интоксикация — при дозе этанола 100 мг/дл; наркотическое состояние — 200—250 мг/дл.; кома и остановка дыхания — 300—400 мг/дл. Смертельная доза алкоголя составляет от 4 до 12 г на 1 кг массы тела.
Этанол обладает мощным психотропным эффектом. На головной мозг алкоголь действует как мощный депрессант, при этом происходит угнетение ряда контрольных центров и одновременно активируются механизмы возбуждения. Поражаются кора головного мозга, лимбическая система, подкорковые структуры, мозжечок и нижние отделы стволовой части мозга.
Механизмы их развития неясны. Этанол, воздействуя на мембранные рецепторы к гамма-аминомасляной кислоте, снижает утилизацию кислорода в нервных клетках, что может способствовать подавлению функции нейронов мозга.
В течение острого отравления алкоголем можно выделить два периода: токсикогенный и соматогенный. В токсикогенном периоде развивается коматозное состояние и другие неврологические расстройства, а также нарушения дыхания, сердечно-сосудистой системы и почек. Смерть может наступить от острой сердечно-легочной, сердечной и почечной недостаточности. В соматогенном периоде прогрессируют психоневрологические расстройства, воспалительные поражения органов дыхания, миоренальный синдром.
Ведущие изменения в дыхательной системе связаны с развитием местных изменений, которые нередко сочетаются с расстройством дыхания центрального генеза. Местные изменения в легких представлены аспирационной пневмонией, респираторным дистресс-синдромом взрослых, бронхоспазмом, асфиксией вследствии аспирации рвотных масс или в связи с западением языка.
Хронический алкоголизм или хроническая алкогольная интоксикация определяется как совокупность патологических изменений, возникающих в организме под влиянием длительного неумеренного употребления алкоголя. Термин "хронический алкоголизм" введен в 1849 г. шведским ученым М. Гуссом.
При хроническом чрезмерном потреблении этанола последний вызывает морфологические изменения практически во всех органах и тканях, важнейшие из них центральная нервная система, печень (см. лекцию "Болезни печени"), поджелудочная железа, желудок, сердце. Поражение этанолом миокарда может привести к дилатационной кардиомиопатии. Злоупотребление алкоголем, вызывающим поражение печени, приводит к снижению липопротеиновой фракции, а это ускоряет возникновение коронарогенного поражения сердца.
У пьющих людей очень высока частота регрессивных изменений скелетной мускулатуры, относимых к алкогольной миопатии. Частое употребление спиртных напитков во время беременности может вызвать микроцефалию и умственную отсталость у ребенка, нередко сочетающихся с пороками развития лица и пороками сердца. Такой фетальный алкогольный синдром проявляется у новорожденных, у которых матери, больные алкоголизмом, в период беременности продолжали принимать по 2—3 глотка спиртных напитков в день. Кроме того, при хроническом алкоголизме весьма высок риск развития рака полости рта, глотки, гортани, пищевода, желудка и, по-видимому, прямой кишки и легкого. Совокупная степень риска перечисленных форм рака превышает таковую у обычных людей в десятки раз.
Отравления суррогатами алкоголя. Суррогаты алкоголя представлены препаратами, приготовленными на основе этанола и содержащими различные примеси, а также препаратами, не содержащими этилового спирта и представляющими собой другие одноатомные или двухатомные спирты.
К суррогатам алкоголя, содержащим примеси, относятся гидролизный и сульфитный спирты, денатурат, одеколоны и лосьоны, клей БФ, политура, нигрозин и др. К суррогатам алкоголя второй категории относят метиловый спирт и этиленгликоль.
Метиловый спирт (метанол, древесный спирт) нередко содержится во всевозможных растворителях и антифризах. В чистом виде он обладает слабым спиртовым запахом, и в быту его легко спутать с этиловым спиртом. Прием 5—10 мл метанола приводит к тяжелому отравлению и слепоте, а 30 мл — к смерти. Отравления метанолом расследуют судебные медики. Действующим началом в организме являются метаболиты метанола — муравьиная кислота и формальдегид. Они вызывают метаболический ацидоз, сопровождающийся усиленным образованием, недостаточным окислением или связыванием нелетучих кислот. Эти метаболиты токсичны для сетчатки глаз и нейронов коры большого мозга, поэтому развиваются слепота и депрессия.
Этиленгликоль оказывает нейротоксическое и нефротоксическое действие. На 4—5-й день отравления доминируют симптомы почечно-печеночной недостаточности.
Наркомании.
По данным мировой статистики, около 4% населения Земли регулярно потребляют наркотики, и эта цифра постоянно увеличивается. Наркотики подразделяются на четыре группы: системные депрессанты центральной нервной системы, стимуляторы, наркотики и галлюциногены.
Системные депрессанты центральной нервной системы представлены алкоголем и барбитуратами, вызывают быстрое торможение, депрессию и привыкание.
Системные стимуляторы центральной нервной системы включают кокаин и амфетамины. Кокаин — алкалоид, экстрагируемый из листьев кустарника кока, растущего в тропиках Южной Америки и Азии, как правило, продается в качестве водорастворимого порошка, гидрохлорида кокаина, смешанного с тальком или другим внешне сходным белым порошком. В высоких дозах он является сильным стимулятором центральной нервной системы, блокирующим повторное усвоение гидротартрата норадреналина (норэпинефрина — сосудосуживающего и прессорного стимулятора бета-адренорецепторов сердца), дофамина (сходный механизм действия) и серотонина (обладает периферическим сосудосуживающим эффектом) на уровне пресинаптических нервных окончаний. В результате повышается количество этих нейротрансмиттеров в зонах постсинаптических рецепторов. Кроме того, возрастает синтез норэпинефрина и дофамина. Высокие уровни дофамина вызывают чувство эйфории, артериальную гипертензию, тахикардию и спазм сосудов, которые могут быть причиной коронарного стеноза (сужения коронарных артерий) и роковых ишемических изменений в миокарде. Они связаны со стойким кальцийзависимым спазмом гладких мышц сосудистой стенки независимо от симпатической нервной системы. Сложнее понять механизм тромбоза, который возникает в местах сужения сосудов.
Исчезновение эйфории часто сопровождается депрессией (угнетенным психофизиологическим состоянием). Кокаинизм может способствовать появлению тяжелой сердечной аритмии и внезапной остановки сердца. Кроме того, у таких больных часто развивается инфаркт миокарда на основе острой или хронической (у более пожилых лиц) ишемической болезни сердца. Реже встречаются миокардит и кардиомиопатия с дилатацией желудочков.
Наркотики используются в медицине для снятия боли. Но им также свойственны седативный эффект и способность подавлять настроение. В эту группу входят препараты группы опия — морфин, метадон, кодеин, а также героин и др. Героин является самым опасным наркотиком. Патологический процесс начинается с быстро возникающей зависимости от наркотика, настолько сильной, что у пациента развивается непреодолимый страх перед возможным прекращением его введения.
Опиаты вызывают прогрессирующее привыкание, сопровождаемое все увеличивающимися дозировками для достижения эффекта. Все опиаты влияют на те же специфические рецепторы, на которые воздействуют нормальные эндогенные опиоидные пептиды — энкефалины, эндорфины и динорфины (перечисленные группы опиоидов включают в себя нейропептиды, обладающие морфиноподобным механизмом действия, т.е. регулирующие сон, снижающие боль, страх и т.д.). Указанные рецепторы широко распространены в организме, но в основном они находятся в головном мозге, а также в эндокринной, пищеварительной и сердечно-сосудистой системах. В частности, героин обладает тропизмом к ткани мозга. Будучи относительно нетоксичным в малых дозах, он тем не менее вызывает многочисленные поражения.
Героин может приводить к развитию внезапной смерти при широком диапазоне используемых доз. Высказывается предположение, что это может быть результатом индивидуальной утраты толерантности к героину. Передозировка героином может сопровождаться тремя важнейшими синдромами: глубоким угнетением дыхания, аритмиями и остановкой сердца, тяжелым отеком легких.
Патологическая анатомия передозировки героина. В местах инъекций можно выявить тромбоз локтевых вен, абсцессы кожи, целлюлиты (или панникулиты, т.е. воспаление с фиброзом подкожной клетчатки) и изъязвления кожи. Среди других часто возникающих инфекционных осложнений нужно назвать эндокардит, при котором преимущественно поражаются клапаны правого сердца, особенно трехстворчатый. Возбудителями такого эндокардита обычно являются золотистый стафилококк, а также другие микробы и даже грибы. В легких обнаруживаются пневмония, обусловленная оппортунистической инфекцией, абсцедирование, микробная эмболия, гранулемы (талькоз). Нередко развитие вирусного гепатита В и С, с дельта-суперинфекцией, а также ВИЧ-инфекции. Относительно часто поражаются почки. Преобладают амилоидоз и очаговый гломерулосклероз, которые сопровождаются тяжелой протеинурией и нефротическим синдромом.
Галлюциногены (природные и синтетические). Наиболее известными из них являются марихуана, гашиш (действующее начало тетрагидроканнабинол), фенцимклидин, ЛСД (диэтиламид лизергиновой кислоты). Наиболее широкое рапространение получила марихуана, известная в России как конопля. У хронических наркоманов возникает не только толерантность, но и зависимость. При продолжающемся применении гашиша эти нарушения могут прогрессировать и приводить к снижению распознавательных, психомоторных (управляемых двигательных) и других функций (оценка времени суток, скорости, расстояний, замедление реакций), снижение которых часто приводит к ранениям и гибели в катастрофах. Множество молодых людей, куривших марихуану, погибли в автомобильных и других транспортных катастрофах. Известно, что у некоторых лиц марихуана способна также провоцировать транзиторный (скоротечный) психоз.
Патология, вызванная приемом лекарственных веществ
Патология, вызванная приемом лекарственных веществ, выражается в побочных лекарственных реакциях, развивающихся в ответ на прием лекарственного препарата для лечения, диагностики или профилактики в обычной дозировке. В России распространены термины "лекарственная болезнь", "лекарственная патология", которые входят в более широкое понятие "ятрогенная патология" (ятрогения от греч. iftros — врач и gеnes — порождаемый), т.е. заболевания и их осложнения, вызванные действиями лекарств, медицинских препаратов, а также манипуляциями медицинских работников.
Патологические процессы, возникающие при побочном действии лекарств.
| Патологические процессы, возникающие при побочном действии лекарств | Препарат | |||
| Изменения в крови: гранулоцитопения, апластическая анемия, панцитопения гемолитическая анемия, тромбоцитопения | Противоопухолевые препараты, иммуносупрессоры, левомицетин Пенициллин, метилдофа, хинидин | |||
| Кожные реакции: крапивница, пятна, папулы, везикулы, петехии, эксфолиативный дерматит, стойкая лекарственная сыпь | Противоопухолевые препараты, сульфаниламиды | |||
| Функциональные изменения в сердце: аритмии кардиомиопатия | ТеофилинДоксорубицина гидрохлорид, рубомицина гидрохлорид | |||
| Поражения почек: гломерулонефрит острый некроз канальцевтубулоинтерстициальные поражения с папиллярным некрозом | ПеницилламинАнтибиотики, аминогликозиды, циклоспорин, амфотерицин В Фенацетин, салицилаты | |||
| Изменения в легких: бронхиальная астма острый пневмонит интерстициальный фиброз | Салицилаты ФурадонинМиелосан, фурадонин, блеомицин | |||
| Поражения печени: ожирение гепатоцитов диффузные гепатоцеллюлярные поражения холестаз | ТетрациклиныФторотан, изониазид, парацетамолАминазин, эстрогены, некоторые гормональные противозачаточные средства | |||
| Изменения в центральной нервной системе: шум в ушах и головокружение острые дистонические реакции и паркинсонизм угнетение Кроме того, повышается риск развития аденом и рака печени, холестаза и холецистита, а также артериальной гипертензии. | Салицилаты ФенотиазинСедативные препараты |
В литературе описаны множественные аллергические реакции и дисбактериозы при использовании антибиотиков, легочная гипертензия при использовании препаратов центрального действия, снижающих аппетит, фиброзирующего альвеолита при приеме кордарона. Хорошо известны осложнения кортикостероидной, цитостатической и иммуносупрессивной терапии.
Экзогенные эстрогены. Хорошо известно содействие эндогенной гиперэстрогении развитию рака эндометрия, рака молочной железы, тромбозу и тромбоэмболии легочной артерии.
Оральные контрацептивы. Имеются указания на то, что у пожилых женщин, в течение длительного времени куривших сигареты и в молодые годы пользовавшихся оральными контрацептивами, частота развития тромбоэмболии легочной артерии в 5—10 раз выше среднестатистической. Однако нет данных об увеличении риска венозного тромбоза у некурящих женщин моложе 35 лет, принимающих минипилюли с обычными комбинациями эстрогена и прогестерона, если у них нет каких-либо предрасполагающих заболеваний — гипертензии, сахарного диабета, гиперлипопротеинемии и др. Имеются спорные сведения о повышении частоты инфаркта миокарда у лиц, принимавших оральные контрацептивы.
Риск развития рака молочной железы у женщин, принимавших комбинированные оральные контрацептивы в течение минимум 10 лет, повышается в 1,2—1,4 раза.
Патология, вызванная физическими факторами.
Радиационнной патология.
Механизмы взаимодействий ионизирующей радиации с молекулами и клетками. Ионизирующая радиация представлена двумя видами излучений — электромагнитным (рентгеновским и гамма-излучением) и потоком частиц (альфа-, бета-частиц, протонов, нейтронов и др.). Ретгеновские лучи образуются при ударе потока электронов в газовой трубке о мишень. Длина волны этих электромагнитных лучей зависит от напряжения, ускоряющего электроны. При напряжении на пластинах 70 kV образуется мягкое рентгеновское излучение, плохо проникающее в ткани, а при напряжении 250kV — жесткое излучение, глубоко проникающее.
Гамма-лучи — электромагнитные лучи с короткой длиной волны и большой проникающей способностью. Чем меньше длина волны, тем глубже они проникают в ткани. Проходя сквозь субстрат, электромагнитные лучи отдают свою энергию электронам, при этом формируются электроны с высокой энергией, вызывающие ионизацию вещества.
Альфа-лучи — поток ядер гелия с массой 4, несущих положительный заряд +2.
Бета-лучи — поток электронов с зарядом —1. Длина пробега в воде составляет 1 см.
Протоны имеют массу 2 и заряд +2. Попадая в ядра молекул, они вызывают их нестабильность, различные виды излучений и распад.
Нейтроны не несут заряда и потому глубоко проникают в ткани. Используются в атомных реакторах для производства изотопов и образуются в больших количествах при атомных взрывах.
При контакте с субстратами ионизирующая радиация вызывает его ионизацию. Особенно подробно процессы ионизации изучены для молекул воды.
Авария на ЧАЭС вызвала комбинированное воздействие ионизирующей радиации на организм человека, сочетавшая инкорпорацию радионуклидов в организм и внешнее облучение, исходящее от облака выброса и загрязненной поверхности земли. При этом доминирующим являлось воздействие от поглощенных радионуклидов.
В ходе аварии на ЧАЭС были выброшены радионуклиды, образовавшиеся в самом реакторе под воздействием энергии нейтронов, выделяющихся из делящихся ядер урана, более 200 радиоактивных изотопов в составе топливных частиц реактора, а также в виде частиц из радионуклидов, соединенных со строительной и атмосферной пылью. Радиоактивные пылевые частицы называются "горячими частицами".
Механическая очистка воздуха от "горячих частиц" в организме человека начинается с его фильтрации при прохождении полости носа. При этом происходит осаждение ингалированных частиц на слизистых оболочках носа, трахеи и бронхов с последующим удалением их при чихании и кашле. Осаждение частиц зависит от их диаметра. Так, в носовой полости задерживаются частицы диаметром более 50 мкм, трахее — 30—50 мкм, в бронхах — 10—30 мкм, в бронхиолах — 3—10 мкм, в альвеолах — 1—3 мкм. Частицы, диаметр которых меньше 0,5 мкм, в легких практически не задерживаются.
Геометрический диаметр частиц не соответствует аэродинамическому (АД). АД численно равен среднему геометрическому диаметру, умноженному на корень квадратный из плотности частицы, выраженной в единицах г/см. Так, например, при геометрическом диаметре 0,3 мкм частицы диоксида урана с плотностью 10 г/см АД составляет 1 мкм.
Состав "горячих частиц" взорвавшегося реактора ЧАЭС имел специфический радионуклидный состав, что объясняется особенностями использованного уранового топлива, а также вторичных строительных и атмосферных примесей. Cs137, попавший в первые дни аварии в организм обслуживающего персонала станции, входил в состав частиц с АД 5—25 мкм. Средний же АД частиц, содержавших Ри239, соответствовал по расчетным данным 12±2 мкм. Это свидетельствует о том, что данные частицы оседали, в основном, в мелких бронхах и бронхиолах. В целом же размер "горячих частиц" ЧАЭС колебался от 4 до 40 мкм, что приводило к поражению респираторного тракта на всех уровнях, начиная от верхних дыхательных путей и кончая альвеолами, что подтверждается данными клинического наблюдения за ликвидаторами чернобыльской катастрофы.
Аспирированные "горячие частицы" оказывают уникальное повреждающее воздействие на ткань легкого, так как способны накапливаться в определенных структурах, прежде всего по ходу лимфатических дренажей, а также в очагах пневмосклероза, где фактически возникают источники постоянно происходящего альфа- и бета- излучения. Этим и объясняется тот факт, что даже при низкой мощности таких источников общая доза локального облучения может быть высока. Не вызывает сомнений, что такое воздействие ионизирующей радиации является достаточным, чтобы вызвать цепь генных мутаций и перестроек, ведущих к развитию рака легкого. Однако данные о риске рака легкого, индуцированного микроскопическими источниками альфа- и бета- излучения, противоречивы.
Теории канцерогенного действия ионизирующей радиации. Существуют две теории канцерогенного действия ионизирующей радиации: теория прямого воздействия и теория опосредованного воздействия.
Теория прямого канцерогенного воздействия ионизирующей радиации основывается на данных о ее повреждающем действии различных биомолекул, прежде всего ДНК и ферментов. Прямое взаимодействие с субстратом ионизирующей радиации приводит к захвату энергии субстратом, его ионизации и разрушению. При этом могут возникать летальные повреждения, вызывающие моментальную смерть клетки. Моментальная смерть клетки развивается при дозе более 10000 рад вне фазы митоза и называется интерфазной смертью.
Наиболее опасны нелетальные повреждения, ведущие к мутациям и злокачественной трансформации клеток. Нелетальные повреждения ДНК могут заключаться в разрыве и разрешении как одной из комплементарных цепочек ДНК, так и двух цепочек одновременно.
При повреждении одной из цепочек возможна полная репарация поврежденного участка за счет сохранной комплементарной цепочки. Однако при нарушении системы генов репарации ДНК (эндонуклеаз, лигаз, ДНК-полимераз) восстановления не происходит, что ведет к возникновению генных и хромосомных мутаций.
Повреждение одновременно двух цепочек спирали ДНК может приводить к разрывам ДНК и возникновению необратимых мутаций. Репарация ДНК становится невозможной.
Теория опосредованного воздействия ионизирующей радиации на субстрат связывает ее канцерогенное действие с образованием активных радикалов, прежде всего активных форм кислорода — атомарного кислорода, гидроксил-радикала, супероксид-радикала и перекиси водорода. Активные радикалы взаимодействуют с липидами мембран, ферментами и нуклеиновыми кислотами, вызывая изменения этих молекул, что приводит к разрушению клеточных мембран и митохондрий, мутации ДНК.
Достижения экспериментальной и клинической онкологии ХХ века позволили установить, что развитие опухолей является результатом возникновения мутаций в соматических клетках, происходящих при повреждении молекул ДНК. Это заключение подтверждается тремя группами фактов: 1) наличием корреляций определенных хромосомных мутаций с некоторыми типами опухолей; 2) развитием опухолевого фенотипа в клетках при трансфекции в них онкогеннных вирусов; 3) обнаружением мутагенных свойств у большинства известных канцерогенных агентов.
Морфогенез и морфологическая характеристика радиационного центрального и периферического рака легкого. Радиационный рак легкого является типичным примером рака, возникшего в результате захвата радионуклидов тканями организма. Поэтому инициальным звеном в морфогенезе радиационного рака легкого является захват и депонирование в легочной ткани радионуклидов.
Бронхи являются основной мишенью альфа-облучения, исходящего от частиц радона, вдыхаемых с воздухом как в группах населения с профессиональными вредностями, так и вследствие содержания радона в жилищах.
Согласно данным Американской академии наук, достаточная доза радиации, необходимая для индукции злокачественной трансформации бронхиального эпителия радоновыми продуктами, на 30% ниже той, которую получают шахтеры на урановых рудниках.
В естественных условиях радионуклидные частицы имеют сложный состав и содержат не только радиоактивные элементы, но и пылевые частицы различной природы из окружающей атмосферы. В случае, если аспирация радионуклидов происходит в условиях запыления, это может приводить к сочетанному воздействию на легочную ткань — радиоактивному и пылевому.
В зависимости от размеров вдыхаемых ядерных частиц они могут поступать, а затем оседать и задерживаться в различных участках дыхательной системы. Так, например, аспирированные частицы диаметром 1—5 мкм достигают респираторных отделов легкого, где могут захватываться и накапливаться альвеолярными макрофагами. Частицы, размеры которых достигают 20—40 мкм, оседают на слизистой оболочки верхних дыхательных путей и повреждают эпителий крупных бронхов.
Данные особенности локализации инициального повреждения легочных тканей при радионуклидных поражениях лежат в основе развивающихся в легких патологических процессов как в их центральных отделах (в крупных бронхах), так и в периферических (в мелких бронхах, бронхиолах, альвеолах, интерстиции респираторных отделов).
В случае мелких размеров частиц и повреждения слизистой оболочки мелких бронхов, бронхиол и альвеол возникают бронхиты, бронхиолиты и фиброзирующий альвеолит. Накопление радионуклидов в интерстиции, а также хроническое воспаление приводят к возникновению очагового и диффузного интерстициального пневмослероза, создающего благоприятный фон для развития периферического рака легкого.
Депонированию радионуклидов в легочной ткани способствуют альвеолярные макрофаги. Развивающийся при этом фиброз также благоприятствуют накоплению в легочной ткани радиоактивного материала, поскольку ведет к нарушениям лимфо- и кровообращения в легочной ткани.
Радионуклиды могут захватываться не только альвеолярными макрофагами, но и эпителиальными клетками, оказывая на них прямое повреждающее действие и индуцируя злокачественную трансформацию. Об этом свидетельствуют данные об обнаружении в клетках периферической аденокарциномы легкого ликвидатора аварии на Чернобыльской АЭС радиоактивного Cz.
В развитии радиационного периферического рака легкого пневмосклероз имеет важное значение как фоновый патологический процесс. С одной стороны, процесс образования фиброзной ткани в легком следует рассматривать как адаптивный процесс, обеспечивающий некоторую защиту тканей от воздействия ионизирующей радиации, с другой стороны, склеротические изменения могут создавать дополнительные условия для злокачественной трансформации эпителиальных клеток. Развитию склеротических изменений в легких могут способствовать также те пылевые примеси, которые аспирируются в легкие вместе с радионуклидами. Морфогенез периферического рака легкого примерно в 73% случаев связан с очаговым и/или диффузным пневмосклерозом.
При попадании крупных радиоактивных частиц основные изменения локализуются в крупных бронхах, где на фоне хронического воспаления могут развиваться дисрегенераторные изменения эпителия — метаплазия и дисплазия, относящиеся к предраковым изменениям. Возникающий при этом рак легкого имеет центральную локализацию.
У всех ликвидаторов последствий взрыва на ЧАЭС в первые же годы развилось хроническое воспалительное вяло текущее поражение бронхиального дерева — хронический обструктивный бронхит, нередко с деструктивным компонентом, и бронхиальная астма. Кроме того, обнаруживались изменения на уровне респираторных отделов легкого — признаки интерстициального фиброза. У многих больных регистрируются эхокардиографические и электрокардиографические признаки легочного сердца.
ТРАВМАТИЧЕСКАЯ БОЛЕЗНЬ. БОЕВАЯ ОГНЕСТРЕЛЬНАЯ ТРАВМА. ОЖОГОВАЯ БОЛЕЗНЬ
Начиная с доисторических времен, перед человечеством остро стоит вопрос лечения ран и травм, полученных в результате вооруженных конфликтов, войн, природных стихийных бедствий и техногенных катастроф. Из пяти с половиной тысяч лет развития человеческой цивилизации, прослеженных и изученных исторической наукой, только в течение 300 лет на Земле не было значимых вооруженных конфликтов. Практически с момента своего появления, представители вида Homo Sapiens использовали в выяснении отношений оружие не только контактного, но и дистантного типа воздействия. Первым примером такого типа оружия может быть камень, брошенный в соплеменника при помощи простейшего метательного приспособления — пращи. Бесконечные междоусобицы и войны вынуждали совершенствовать оружие дистантного типа.
Испытывая на себе результаты собственных изобретений и открытий, люди, с одной стороны, были вовлечены в бесконечную борьбу по улучшению характеристик оружия, а с другой — искали эффективные средства защиты и способы лечения полученных ран.
Вооружение всегда соответствовало научно-техническому потенциалу создававшего его общества. Научно-технический прогресс в ХХ и XXI вв. прежде всего характеризуется развитием различных видов вооружений, совершенствованием их количественных и качественных характеристик. Сегодня только взрывчатых веществ накоплено около 15 тонн на каждого жителя Земли в пересчете на тротиловый эквивалент. На вооружении армий имеется самое разнообразное оружие: огнестрельное (включая стрелковое), минно-взрывное, высокоточное, объемно-детонирующего действия, ракетно-ядерное, химическое, биологическое, термическое. Из новых видов оружия следует назвать микроволновое, инфразвуковое и геофизическое.
Люди технически готовы вести метеорологические и экологические войны.
Не менее значимой проблемой для современной цивилизации являются различные техногенные и природные катастрофы. Количество раненых и погибших, а также особенности ранений и травм, возникающих в условиях различных стихийных бедствий или промышленных аварий, сопоставимы с таковыми при локальных вооруженных конфликтах, что позволяет рассматривать их с тех же позиций, что и повреждения, полученные в боевых условиях. Массовость и массивность поражений, тяжелейшие повреждения и их внешний вид вызывают не только физическую, но и психическую травму, которая имеет свои особенности и проявления и оказывает влияние на реактивность организма, уровень его приспособительных и компенсаторных реакций.
Изучение совокупности повреждений и реакций организма на воздействие различных повреждающих факторов породило понятие травматическая болезнь, которая характеризуется общими патогенетическими механизмами, закономерностями развития комплекса повреждений, возникающих в организме при современной травме. Изучение этих особенностей необходимо для разработки комплексного лечения травматической болезни, включающего не только хирургическую обработку механических или ожоговых ран, но и воздействие на весь комплекс изменений, возникающих в организме при современной травме.
Травматическая болезнь складывается, в основном, из общих закономерностей развития повреждений в организме и особенностей механической травмы, огнестрельной, минно-взрывной или других видов травм, в том числе и термических поражений, которые получили название "ожоговой болезни", являясь, тем не менее, частным видом травматической болезни.
Классификация травм и ранений.
При наличии у одного пострадавшего нескольких ранений различают комбинированное, множественное или сочетанное ранение.
Комбинированным называется ранение, вызванное различными повреждающими факторами (например, огнестрельное ранение и поражение отравляющими веществами) или различными поражающими факторами одного и того же вида оружия (ожог, механическая травма и поражение проникающей радиацией вследствие ядерного взрыва).
Множественное ранение — ранение различных областей тела в результате воздействия одного повреждающего фактора (например, осколочные ранения нескольких анатомических областей, множественные ожоги тела).
Сочетанное ранение — ранение нескольких анатомических областей тела, нанесенное одним ранящим снарядом (например, торакоабдоминальное пулевое ранение).
В условиях военных конфликтов, техногенных катастроф и стихийных бедствий величина и структура потерь может иметь значительные колебания в зависимости от вида боевых действий, времени года, погодных, географических и других условий, однако ведущими поражающими факторами являются механические (31,0—33,4 %) и термические поражения (11,6—19,0 %).
Травматическая болезнь.
В условиях современных вооруженных конфликтов, а также при техногенных и природных катастрофах большой процент повреждений приходится на политравму, т.е. комбинированные, множественные или сочетанные ранения. Наиболее опасным проявлением политравмы служит развитие у пострадавших травматической болезни. Травматическая болезнь наблюдается примерно у 50—60% пораженных, имеющих политравму. В зависимости от степени тяжести травмы летальность составляет от 10 до 90%. Степень тяжести травмы в значительной мере определяется развитием или отсутствием шока, а также его выраженностью. Если развивается шок первой степени, такая травма считается легкой, и травматическая болезнь у большинства пострадавших не развивается. При травме средней степени тяжести вероятность развития травматической болезни составляет около 20%, а летальность (при условии развития травматической болезни) — около 10%. При тяжелой степени травмы, когда развивается шок третей степени, травматическая болезнь наблюдается у всех пострадавших, а вероятность выздоровления составляет около 60%. Если травма признана несовместимой с жизнью, развивается самое тяжелое течение травматической болезни.
Травматическая болезнь — это комплекс вторичных изменений, возникающих в организме в результате травмы. Термином "травматическая болезнь" прежде всего обозначают изменения, вызванные механической травмой В зависимости от тяжести поражения и уровня вовлеченности в процесс различных систем организма выделяют легкую, среднюю и тяжелую степени травматической болезни.
Патогенез травматической болезни
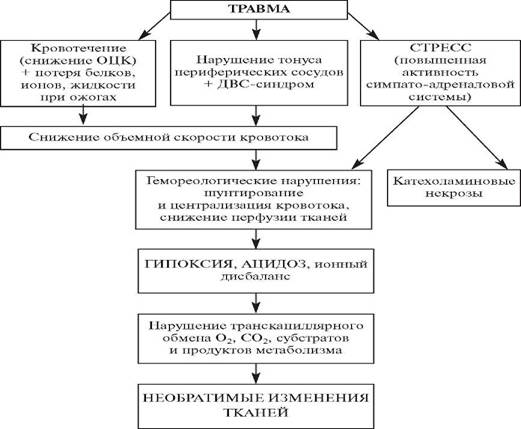
Патогенез травматической болезни
В течение травматической болезни выделяют следующие основные периоды: 1) период первичных реакций на травму и ранние осложнения; 2) период травматического шока; 3) период последствий первичных реакций на травму и последствий шока; 4) период поздних осложнений травмы; 5) период реконвалесценции и отдаленных последствий травмы.