НАБОР ЗАДАНИЙ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ
Донецкий национальный медицинский университет им. М.Горького
Кафедра общей и биологической химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К практическим занятиям по медицинской химии
Для студентов первого курса медицинских факультетов.
Лиман - 2016
Авторы:
Ассистент кафедры общей и биологической химии к.х.н. Горкуненко О.А.
Доцент кафедры общей и биологической химии к.биол.н. Федорова А.А.
Заведующая кафедры общей и биологической химии, доцент, к.биол.н. Богатырева Е.В.
Доцент кафедры общей и биологической химии, к.х.н. Холмовой Ю.П.
Доцент кафедры общей и биологической химии, к.х.н. Санталова А.А.
Доцент кафедры общей и биологической химии, к.х.н. Марченко И.Л.
Доцент кафедры общей и биологической химии, к.х.н. Юсина А.Л.
Ассистент кафедры общей и биологической химии к.х.н. Володченко И.И.
Рецензенты:
Заведующий кафедры химии Донбасской машиностроительной академии
д.х.н., профессор Авдеенко А.П.
Заведующий кафедры фармакологии, клинической фармакологии и фармакотерапии
д.фарм.н., профессор Хоменко В.Н
СОДЕРЖАНИЕ
Тема 1. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 4
Тема 2. БИОГЕННЫЕ S- И P- ЭЛЕМЕНТЫ, БИОЛОГИЧЕСКАЯ РОЛЬ, ПРИМЕНЕНИЕ В МЕДИЦИНЕ.. 10
Тема 3. БИОГЕННЫЕ d- ЭЛЕМЕНТЫ; БИОЛОГИЧЕСКАЯ РОЛЬ, ПРИМЕНЕНИЕ В МЕДИЦИНЕ 14
Тема 4. КОМПЛЕКСООБРАЗОВАНИЕ В БИОЛОГИЧЕСКИХ СИСТЕМАХ.. 17
Тема 5. РАСТВОРЫ. ЭЛЕКТРОФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ.. 20
Тема 6. РАСТВОРЫ. ПЕРМАНГАНАТОМЕТРИЯ КАК МЕТОД ОБЪЕМНОГО КОЛИЧЕСТВЕННОГО АНАЛИЗА.. 26
Тема 7. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. 29
Тема 8. КИНЕТИКА БИОХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.. 33
Тема 9. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.. 36
Тема 10. ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ.. 40
Тема 11. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ В ОРГАНИЗМЕ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ.. 43
Тема 12. БУФЕРНЫЕ СИСТЕМЫ, КЛАССИФИКАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ. 46
ЛАБОРАТОРНЫЙ ПРАКТИКУМ (по содержательным модулям 1-3) 50
Тема 13. СОРБЦИЯ БИОЛОГИЧЕСКИ-АКТИВНЫХ ВЕЩЕСТВ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ. 55
Тема 14. ДИСПЕРСНЫЕ СИСТЕМЫ. ПОЛУЧЕНИЕ, ОЧИСТКА И СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ. 59
Тема 15. ЛИОФОБНЫЕ ЗОЛИ И ИХ СВОЙСТВА. КОАГУЛЯЦИЯ. 63
КОЛЛОИДНАЯ ЗАЩИТА. 63
Тема 16. СВОЙСТВА РАСТВОРОВ БИОПОЛИМЕРОВ. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКА. 68
ЛАБОРАТОРНЫЙ ПРАКТИКУМ (по содержательным модулям 4, 5) 72
Вопросы к итоговому занятию по медицинской химии. 76
СПИСОК ЛИТЕРАТУРЫ... 79
Тема 1. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
АКТУАЛЬНОСТЬ ТЕМЫ
Отличительная черта современной медицины – активное внедрение достижений химии в теорию и практику исследований функций живого организма. Медицинская химия изучает химические основы процессов жизнедеятельности живого организма, которые подчиняются основным химическим закономерностям. Большинство процессов, происходящих в живом организме, объясняются на основании теоретических положений неорганической, физической и коллоидной химии. Например, изменение структуры и функций клеток крови в растворах кровезаменителей объясняется законами осмотического давления. Не менее важную роль играют законы кинетики и катализа, которые дают возможность понимать закономерности протекания ферментативных процессов.
Особую роль приобретает знание основ медицинской химии, которая служит фундаментом при последующем изучении биоорганической и биологической химии, фармакологии, физиологии, гистологии, санитарии и гигиены, анестезиологии.
Прогресс современной медицины во многом обусловлен достижениями в химии. Положительный эффект врачебной деятельности на 70% определяется наличием лекарственных препаратов, большинство которых синтезировано химиками.
Периодический закон и созданная на его основе периодическая система элементов Д.И. Менделеева являются одним из основных законов естествознания, фундаментом современного учения о строении материи. Значение этого закона выходит далеко за пределы химии. Успехи атомной и ядерной физики атома стали возможны лишь благодаря периодическому закону. С другой стороны, теоретические положения квантовой механики расширили и углубили содержание периодического закона.
В окружающей природе, в живом организме химические элементы образуют большое число неорганических соединений. Их классификация позволяет проследить закономерности изменений свойств соединений, выявить взаимосвязь между ними, произвести обобщение. Это помогает изучению большого объема фактического материала и дает возможность прогнозировать протекание той или иной реакции между веществами.
Знание периодического закона и периодической системы Д.И. Менделеева, а также основных классов неорганических соединений необходимы студентам для дальнейшего изучения ими курсов биохимии, фармакологии и клинических дисциплин.
ЦЕЛИ ОБУЧЕНИЯ
ОБЩАЯ ЦЕЛЬ:
Уметь трактовать периодическую систему Д.И. Менделеева, составлять электронные и электронно-графические формулы элементов, на основании положения элемента в системе характеризовать его свойства и свойства его важнейших соединений, а так же анализировать химические свойства основных классов неорганических соединений.
КОНКРЕТНЫЕ ЦЕЛИ.
УМЕТЬ:
1. Интерпретировать понятия период, группа, подгруппа.
2. Интерпретировать сущность порядкового номера элемента, периодичность изменения свойств элементов, а также понятия: потенциал ионизации, сродство к электрону, электроотрицательность, радиус атома и ионов.
3. Интерпретировать изменение металлических и неметаллических, окислительно-восстановительных свойств элементов в группах и периодах.
4. Трактовать зависимость кислотно-основных свойств оксидов и гидроксидов от положения элемента в периодической системе Д.И. Менделеева.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
1. Вступление к практикуму. Роль курса медицинской химии.
2. Развитие периодического закона. Закон Мозли. Современная трактовка периодического закона.
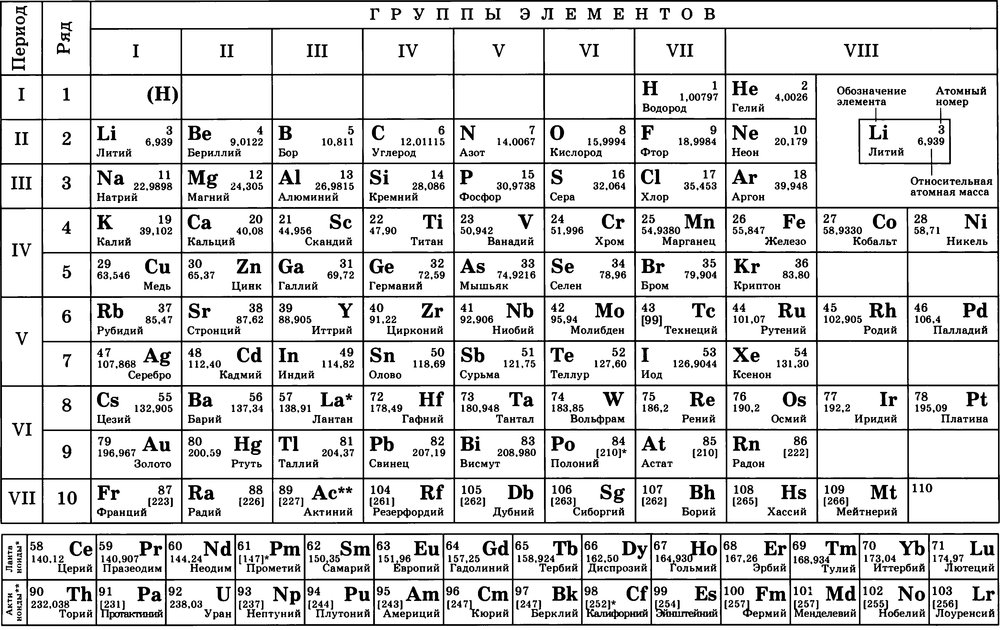
3. Структура периодической системы и её обоснование с позиций теории строения атома (см. Приложение 1).
4. Периодичность изменения свойств атомов: атомных и ионных радиусов, потенциала ионизации, энергии ионизации, энергии сродства к электрону, электроотрицательности.
5. Классы оксидов, гидроксидов, кислот и солей. Их классификация.
6. Изменение окислительно-восстановительных, кислотно-основных свойств кислородных соединений, устойчивости водородных соединений.
7. Роль периодического системы Д.И. Менделеева в современной химии.
Основная литература.
1. Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 7-24.
РЕШЕНИЕ ОБУЧАЮЩИХ ЗАДАЧ
Задача 1.
Напишите электронные формулы атомов элементов с порядковыми номерами 20 и 50, укажите, к каким элементам они относятся.
Эталон решения:
Элементы с порядковыми номерами 20 и 50 в периодической системе – это кальций и олово. Порядковый номер элемента показывает заряд ядра и число электронов в атоме. Используя номер периода, в котором находится каждый из элементов, их электронные формулы можно изобразить:
Са KL 3s23p64s2; Кальций – s-элемент;
Sn KLM 4s24p65s2; Олово – р-элемент.
Задача 2.
Напишите электронные формулы атомов хлора и стронция, и их ионов Сl–, Sr2+.
Эталон решения:
Электронные формулы атомов элементов имеют вид:
Сl KL 3s23p5;
Sr KLM 4s24p65s2.
Атом хлора, принимая электрон, превращается в однозарядный ион с восьмиэлектронной внешней оболочкой. Атом стронция, отдавая 2 электрона, превращается в двузарядный катион. Электронные формулы ионов имеют вид:
Сl– KL 3s23p6;
Sn2+ KLM 4s24p65s0.
Задача 3.
Пользуясь правилом Клечковского и положением элементов в периодической системе, укажите, нейтральным атомам каких элементов, отвечают электронные формулы:
KL 3s23p63d14s2
KLM 4s24p2.
Приведите формулы их ионов Е3+ и Е2+.
Эталон решения:
Значения главного квантового числа внешнего электронного уровня указывают на то, что элементы находятся в 4-м периоде, причем один из них d-элемент, а другой – р-элемент, на это указывают незаполненные d-орбитали и соответственно р-орбитали. Число валентных электронов 3d14s2 и 4s24p2 подтверждают, что эти элементы соответственно 3-ей и 4-ой групп периодической системы. Значит это элементы – скандий и германий. Для получения катиона Sc3+ из атома нужно удалить два s- и один d-электрон, для получения катиона германия необходимо удалить из нейтрального атома два р-электрона. Тогда электронные формулы ионов имеют вид:
Sc3+ KL 3s23p63d104s0;
Ge2+ KLM 4s24p0.
Задача 4.
Дайте сравнительную характеристику элементов хлора и марганца.
Эталон решения:
Хлор и марганец – элементы седьмой группы, атомы которых имеют одинаковые число валентных электронов, равное номеру группы. Высшая степень окисления элементов +7, поэтому формулы высших оксидов – Cl2O7 и Mn2O7. Они характеризуются кислотными свойствами, в качестве гидроксидов им соответствуют сильные кислоты HClO4 и HMnO4. Валентные электроны этих элементов находятся на разных энергетических уровнях: у атома хлора это s- и р-электроны внешнего уровня, для завершения которого не хватает одного электрона. Поэтому хлор – типичный неметалл, сильный окислитель.
У атома марганца валентными являются 2 s-электрона внешнего и 5 d-электронов предпоследнего энергетических уровней, поэтому марганец – типичный металл, сильный восстановитель.
Соединения этих элементов в низших степенях окисления отличаются по свойствам. Низший оксид марганца MnO – основной оксид, которому соответствует слабое основание Mn(OH)2, а низший оксид хлора Cl2O – кислотный оксид, ангидрид слабой хлорноватистой кислоты HClO.
НАБОР ЗАДАНИЙ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ
Задание 1.
Элементы характеризуются определенной периодичностью в изменении их свойств в периодической системе. Укажите фактор, определяющий эти изменения.
A. Заряд ядра атома
B. Степень окисления
C. Валентность
D. Атомный радиус
E. Электроотрицательность
Задание 2.
Одна из классификаций химических элементов основана на строении их электронных оболочек. Согласно этой классификации все элементы можно разделить на s-, p-, d- и f-элементы. Укажите р- элементы:
A. S, P, Cl
B. K, Ca, Se
C. Ba, Mg, Al
D. Mn, Br, Mo
E. P, S, Cr
Задание 3.
Свойства ионов зависят от их положения в периодической системе. Укажите, как изменяются восстановительные свойства в ряду: Сl– – Br– – I–
A. Уменьшаются
B. Увеличиваются
C. Не изменяются
D. Бром более сильный восстановитель, чем хлор
E. Не проявляют восстановительных свойств
Задание 4.
Степень окисления элемента определяется его электронной структурой, которая зависит от положения элемента в периодической системе. Укажите элемент, который имеет только положительную степень окисления.
A. Магний
B. Сера
C. Хлор
D. Кислород
E. Фтор
Задание 5.
Все элементы в периодической системе располагаются в главных и побочных подгруппах. Укажите, какой фактор отличает элементы побочных подгрупп.
A. Являются d- и f-элементами
B. Являются металлами
C. Являются инертными газами
D. Являются s-элементами
E. Являются неметаллами
Задание 6.
К р- элементам IV группы периодической системы относятся углерод, кремний, германий, олово и свинец. Укажите, как изменяются кислотные свойства элементов в этом ряду.
A. Увеличиваются
B. Уменьшаются
C. Не изменяются
D. Сначала увеличиваются, потом уменьшаются
E. Сначала уменьшаются, потом увеличиваются
Задание 7.
Соединение меди CuSO4∙5H2O используется в фармации в качестве бактерицидного препарата. Какая формула отвечает электронной конфигурации элемента 29Cu?
A. 3d104s1
B. 3d94s2
C. 3d64s2
D. 3d84s2
E. 3d74s2
Задание 8.
Для количественного определения многих лекарственных средств используют неводные растворы хлорной кислоты. Какой из приведенных оксидов соответствует этой кислоте?
A. Cl2O7
B. ClO
C. ClO2
D. Cl2O3
E. CI2O6
Задание 9.
Малотоксичный оксид азота (I) под названием «веселящий газ» применяется в медицине для наркоза при хирургических операциях. Выберите это соединение.
A. NO
B. NO2
C. N2O
D. N2O3
E. N2O5
Задание 10.
Объясните причину «проскока» внешнего s-электрона в атомах хрома и меди.
Задание 11.
Укажите символы химических элементов, ионам которых отвечают электронные формулы:
E–2 [He] 2s22p6
E– [Ne] 3s23p6
E+2 [Ne] [Ar]3d5; [Ar] 3d2; [Ar] 3d3
Эталоны ответов:
1 – А, 2 – А, 3 – В, 4 – А, 5 – А, 6 – В, 7 – А, 8 – А, 9 – С.
Приложение 1.