Коллигативные свойства растворов
Образование раствора рассматривается как процесс простого «физического» смешения компонентов, не сопровождающийся изменениями. Такой раствор называется идеальным. Зависимость между парциальными давлениями пара компонентов раствора и их концентрациями является важнейшей характеристикой в поведении идеальных растворов.
Для жидкостей, растворимых друг в друге в любых соотношениях, выполняется закон,
показывающий, что относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Этот закон называется законом Рауляивыражается формулой:
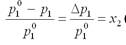 |
где р1 - давление насыщенного пара растворителя над раствором;
р°1 - давление насыщенного пара над индивидуальным растворителем;
Δр – абсолютное понижение давления пара;
х1 и х2– мольные доли растворителя и растворенного вещества в растворе.
Установлены следующие закономерности:
1) повышение температуры кипения раствора пропорционально количеству молей растворенного вещества при условии, что количество молей растворителя постоянно:
Δtкип = Е × Сm
где Е – эбулиоскопическая константа, величина которой имеет вполне определенное значение для каждого растворителя и не зависит от природы растворенного вещества;
Сm – моляльная концентрация вещества, моль/кг.
2) понижение температуры замерзания раствора пропорционально числу молей растворенного вещества при постоянном количестве растворителя:
Δtзам = К × Сm
где К – криоскопическая константа, величина которой не зависит от природы растворенного вещества, а зависит только от природы растворителя;
Сm – моляльная концентрация вещества, моль/кг.
Некоторые физические свойства разбавленных растворов зависят от концентрации и не зависят от природы растворенных веществ в растворе. Эти свойства называются коллигативными (от лат. сolligatus – собирать).
При изучении свойств растворов широко применяют полупроницаемые перегородки – мембраны, характерной особенностью которых является их способность пропускать молекулы растворителя, но задерживать частицы растворенного вещества.
Явление массопереноса растворителя через полупроницаемую мембрану, сквозь которую могут просачиваться малые молекулы, но не способны проходить большие молекулы из разбавленного раствора в раствор более высокой концентрации, называетсяосмосом.
Давление, которое необходимо создать с той стороны мембраны, где находится раствор, чтобы приостановить осмос, называетсяосмотическим давлением.
Вант-Гофф вывел уравнение зависимости осмотического давления (растворов неэлектролитов) от концентрации:
C · R · T
π – осмотическое давление раствора, Па;
С – концентрация растворённого вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/моль·К;
Т – абсолютная температура, К.
Закон Вант-Гоффа: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре.