Влияние концентрации на скорость химической реакции.
Приложение 1
Действие желудочного сока на белки.
А.
- В одну пробирку налейте 2 мл белка, а в другую столько же желудочного сока.
- Осторожно нагрейте пробирку с желудочным соком в водяной бане до 37o-40o С.
- Растворы двух пробирок смешайте.
- Что наблюдаете? Сделайте вывод о влиянии температуры на работу ферментов желудочного сока.
Б.
- В одну пробирку налейте 2 мл раствора крахмала, а в другую столько же желудочного сока.
- Осторожно нагрейте пробирку с желудочным соком в водяной бане до 37o - 40o С.
- Растворы двух пробирок смешайте.
- Что наблюдаете? Сделайте вывод об избирательном действии ферментов.
В.
- В одну пробирку налейте 2 мл раствора белка, а в другую столько же желудочного сока.
- Пробирку с желудочным соком охладите в стакане со льдом 0o С.
- Растворы двух пробирок смешайте.
- Что наблюдаете? Сделайте вывод о влиянии температуры на работу ферментов желудочного сока.
Г.
- В одну пробирку налейте 2 мл раствора белка, а в другую столько же желудочного сока.
- В пробирку с желудочным соком добавьте несколько капель щелочи.
- Смешайте содержимое первой и второй пробирки.
- Что наблюдаете? Сделайте вывод о влиянии характера кислотности среды на работу ферментов желудочного сока.
Ход урока(для химико-технологического профиля )
I этап. Вступительное слово учителя.
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома.
Долька яблока уже через несколько часов покрывается бурой плёнкой, петарда брошенная в костёр, оглушительно взрывается. Интересно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости реакции. Одной реакции требуется для завершения микросекунды, другой–миллионы лет.
Вопросы ученикам.
- Что называетя скоростью химической реакции?
- Как определить скорость для гомогенной реакции?
- Гетерогенной реакции? От каких факторов зависит скорость реакции?
- Приведите примеры.
- Напишите на доске математическое выражение закона действующих масс, правила Вант–Гоффа.
II этап. Цель урока.
Установить графическую зависимость влияния концентрации на скорость реакции.
Экспериментально подтвердить правило Вант–Гоффа.
III этап. Исследовательская работа.
Учитель проделывает опыт: к 0,1 M раствору Na2S2O3 приливает 0,1 М раствор H2SO4.
Идёт реакция: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O.
Через некоторое время после начала реакции появляется сера в дисперсном состоянии, что обнаруживается по голубоватой опалесценции раствора. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить о скорости реакции. Чем меньше время, тем больше скорость реакции и наоборот.
Объяснив сущность реакции, учитель предлагает каждой группе учащихся выполнить задание согласно их инструктивной карточки (см. приложение 2).
IV этап. Отчет групп о проделанной работе.
Результаты опытов заносим в таблицуна доске.
| № группы | Кол – во мл | |||||
| Na2 S2O3 | H2O | Кол-во мл 0,1М H2SO4 | Время , t сек | Температура | Скорость реакцииции моль/л·с | |
| А | комнатная | |||||
| Б | комнатная | |||||
| В | комнатная | |||||
| Г | на 10o выше |
Далее каждая группа считает скорость реакции по изменению концентрации серной кислоты.

Чтобы удобно было считать, перейдём от десятичных дробей к значениям, удобным для восприятия, умножив скорость на 103.
Построив график, учащиеся делают вывод, что скорость реакции зависит от концентрации.
Далее сравниваем результаты опытов А и Г группы. Учащиеся делают вывод, что скорость реакции прямо пропорциональна температуре. Вычисляем, во сколько раз возросла скорость при повышении температуры на 10o.
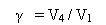
Учащиеся объясняют физический смысл температурного коэффициента.
V этап. Рассказ учащихся о своей исследовательской работе дома (исследование действия различных катализаторов – SiO2, MnO2, KmnO4, NaCl и т.д. – на 3% раствор Н2О2).
VI этап. Закрепление знаний.
Задача. Скорость хранения автомобильных покрышек при температуре 20o – 5 лет, а при температуре 10 o – 13 лет. Сколько лет можно хранить покрышки при 5o ?
VII этап. Заключение.
Учитель подводит итоги работы, отмечает лучшую работу групп, благодарит учащихся за
проделанную работу.
Приложение 2
Влияние концентрации на скорость химической реакции.
А.
- В один химический стакан налейте 10 мл 0,1 М раствора серной кислоты, а в другой стакан – 10 мл 0,1 М раствора тиосульфата натрия + 20 мл воды.
- Растворы двух стаканов смешайте, одновременно запустив секундомер, измерьте время появления опалесценции (помутнения).
- По изменению концентрации серной кислоты вычислите скорость реакции.
Б.
- В один химический стакан налейте 10 мл 0,1 М раствора серной кислоты, а в другой стакан – 20 мл 0,1 М раствора тиосульфата натрия + 10 мл воды.
- Растворы двух стаканов смешайте, одновременно запустив секундомер, измерьте время появления опалесценции (помутнения).
- По изменению концентрации серной кислоты вычислите скорость реакции.
В.
- В один химический стакан налейте 10 мл 0,1 М раствора серной кислоты, а в другой стакан – 30 мл 0,1 М раствора тиосульфата натрия.
- Растворы двух стаканов смешайте, одновременно запустив секундомер, измерьте время появления опалесценции (помутнения).
- По изменению концентрации серной кислоты вычислите скорость реакции.
Г.
- В один химический стакан налейте 10 мл 0,1 М раствора серной кислоты, а в другой стакан – 10 мл 0,1 М раствора тиосульфата натрия + 20 мл воды.
- Раствор во втором стакане осторожно нагрейте на водяной бане до температуры на 10o С выше комнатной.
- Растворы двух стаканов смешайте, одновременно запустив секундомер, измерьте время появления опалесценции (помутнения).
- По изменению концентрации серной кислоты вычислите скорость реакции.
- Сравните свои результаты с группой 1.
- Рассчитайте температурный коэффициент скорости реакции.