Лаб. раб. 2. Определение энтальпии реакции
1. Вычислите ΔH 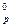 реакции: 2H2S(г) + 3O2(г) ↔ 2H2O(ж) + 2SO2(г) если
реакции: 2H2S(г) + 3O2(г) ↔ 2H2O(ж) + 2SO2(г) если
ΔH0обр, кДж/моль -21 0 -285 -297
2. Рассчитайте энтальпию образования (ΔH 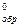 ) хлорида магния (MgCl2), если при образовании 19 г его выделилось 128 кДж.
) хлорида магния (MgCl2), если при образовании 19 г его выделилось 128 кДж.
3. Укажите знак ΔH0 в процессах: а) разложение воды на кислород и водород; б) разложение карбоната кальция на оксид кальция и диоксид углерода; в) растворение серной кислоты в воде.
Лаб. раб. 3. Скорость химических реакций. Химическое равновесие
1. Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе: CO + Cl2 ↔ COCl2.
2. Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе: CuO(к) + H2(г) ↔ Cu(к) + H2O(г).
3. Выразите формулу для вычисления константы равновесия реакции: CS2(ж) + O2(г) ↔ CO2(г) + SO2(г).
4. В каком направлении будет смещаться равновесие обратимой реакции CH3OH + O2 ↔ CO2 + H2O; ΔH<0 при повышении температуры?
Лаб. раб. 4. Растворы электролитов
1. Укажите, какие из солей Al2S3, Zn(NO3)2, K2SO4 гидролизуются? Напишите молекулярные и ионные уравнения гидролиза. Укажите характер (рН) среды в растворах этих солей.
2. Рассчитайте степень диссоциации уксусной кислоты CH3COOH, если концентрация раствора 0,01 моль/л, Кд = 1,8 ∙ 10-5.
3. Определите рН водных растворов НNО3 и НNО2 (Кд = 4,6 · 10-4), если их концентрация равна 0,0075 моль/л.
4. Рассчитайте растворимость хлорида серебра AgCl (моль/л) при комнатной температуре, если ПР = 1,56 ∙ 10-10.
Лаб. раб. 5. Окислительно-восстановительные реакции
1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
B(C2H5O)3 + O2 → B(OH)3 + CO2 + H2O
AgNO3 → Ag + NO2 + O2
NH3 + Br2 → N2 + NH4Br
2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
монооксид углерода + оксид дижелеза (III)-железа (II) → оксид железа (II) + …
Лаб. раб. 6. Коррозия металлов и защита от коррозии
1. В каком из контактов: а) Cu/Ag; б) Be/Zn; в) Mn/Mg скорость коррозии больше? Ответ подтвердите расчётами.
2. В контакте с каким из указанных металлов Sn является анодом: Al, Cr, Ca?
3. Составьте схему работы (катодный и анодный процессы) гальванопары Mg/Fe в кислой среде.
Задание к лабораторным работам
Вариант 4
Лаб. раб. 1. Основные классы неорганических соединений
1. Назовите по систематической номенклатуре следующие вещества: H2, P4, NO2, N2O4.
2. Рассчитать давление в сосуде объемом 22,4 л, если при 00С в нем содержится 50 г водорода.
3. В резервуаре емкостью 150 л находится 50 кг угарного газа при 300С. Рассчитать давление газа (в атмосферах).
4. Рассчитать количество литров аммиака при н.у., образующихся по реакции N2 + 3Н2  2NН3 из 1 л азотоводородной смеси состава 1:1 по объему.
2NН3 из 1 л азотоводородной смеси состава 1:1 по объему.
5. Рассчитать количество веществ в реакции:
KClO3  KCl + O2
KCl + O2
200 г х, г у, л