Почему химия важна для геолога?
- Во-первых, Земля на всех уровнях (от атмосферы до ядра) состоит из химических веществ.
- Во-вторых, геологические процессы всегда либо сопровождаются химическими (например, лава взаимодействует с горной породой), либо полностью или частично являются химическими (например, при выветривании горных пород одни вещества превращаются в другие).
- В-третьих, одной из задач геологии является поиск сырья для промышленности. Что будет происходить с сырьём дальше? Химические реакции. Геолог должен знать, как используются полезные ископаемые.
- В-четвёртых, каждый специалист должен заботиться о поддержании здорового состояния окружающей среды, да и о своём собственном здоровье тоже. Знание химии помогает установить источники опасности и нейтрализовать или избежать их.
Но, главное: химия - это интересная и увлекательная наука. Важнейшее место в химии занимает эксперимент, то есть химические реакции. У вас есть возможность научиться делать новые вещества своими руками.
Вот некоторые наиболее известные продукты химической промышленности:
- горючие вещества - бензин, керосин, дизельное топливо, мазут; это продукты переработки нефти, по химическому составу - углеводороды;
- моющие средства - мыла, шампуни, стиральные порошки; их получают из нефти, растительных и животных жиров с применением щелочей; по химическому составу это обычно натриевые или калиевые соли сложных органических кислот;
- лаки и краски; в них содержится органический растворитель, вещества, формирующие плёнку и красящий пигмент; часто это - оксиды металлов, например, в цинковых и титановых белилах.
Можно назвать ещё химические источники тока (аккумуляторы и батареи), средства защиты растений (ядохимикаты, удобрения), лекарства, взрывчатые вещества, строительные и конструкционные материалы и так далее. Зная химию, легче во всём этом разобраться.
2. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Основной объект химии - атом. По современным взглядам, атом - сложная частица, имеющая диаметр несколько десятимиллиардных долей метра (короче: порядка 10–10 м) и массу порядка 10–24-10–25 кг.
Атомы состоят из более мелких частиц (субатомных или элементарных): протонов, нейтронов, электронов. Электромагнитное взаимодействие происходит благодаря фотонам. Бывают и другие элементарные частицы.
Атомы заполнены элементарными частицами неравномерно. В них есть маленькое ядро (диаметром порядка 10–13 м), где сосредоточено более 99,9% массы. Ядро состоит из протонов p+ и нейтронов n0, имеет положительный заряд, равный числу протонов.
Электроны e- имеют отрицательный заряд и расположены вокруг ядра. Они определяют размер атома и участвуют в образовании химических связей. В нейтральном атоме число электронов равно числу протонов.
Вид атомов с одинаковым числом протонов в ядре называют химическим элементом.
Известно более 100 химических элементов. Они имеют названия и с 19 века обозначаются символами. Иногда слева от символа пишут 2 индекса: вверху - массовое число (A= число протонов + число нейтронов = Z+N), внизу - заряд ядра, он же порядковый номер элемента (Z= числу протонов). Например, 168S.
Изотопами называются атомы с одинаковым зарядом ядра и разным числом нейтронов (и поэтому - разной массой).
Обычно в природе химические элементы представлены в виде смеси изотопов, поэтому в Периодической системе некоторые атомные массы сильно отличаются от целых чисел.
Поскольку атомы очень маленькие, их чаще всего рассматривают большими наборами. Обычно количество вещества измеряют в молях.
Моль - это 6,022•10+23 объектов. Данное число называют ещё числом Авогадро NA. Число молей n называют количеством вещества, n = N/NA , где N - число объктов.
1 моль атомов водорода имеет массу примерно 1 грамм. Удобно то, что масса моля атомов в граммах почти точно равна массовому числу.
Может быть, вы помните из курса физики другое определение моля: моль - это количество структурных единиц, равное числу атомов в 12 граммах изотопа углерода-12. Это количество, конечно же - число Авогадро.
Соотношение изотопов углерода-12 и углерода-14 используется для установления возраста ископаемых остатков в биологии и археологии. Это называется радиоуглеродным методом.
Подобные методы применяют и для выяснения возраста горных пород. Так, собственно, и установлены возраст Земли и её геологическая история.
Химические элементы распространены неодинаково. Во Вселенной в целом преобладают водород H и гелий He, они сосредоточены в звёздах. В земной коре преобладают кислород O и кремний Si.
Напомню важный для химии закон Авогадро: при одинаковых условиях одинаковые количества разных газов занимают одинаковые объёмы. Следствие: один моль любого газа занимает при так называемых нормальных условиях (0оС и 1 атм) объём 22,4 л (иначе говоря, молярный объём Vm=22,4 л/моль).
Закон Авогадро является следствием уравнения Менделеева-Клапейрона -
p×V = n×R×T
(n - число молей, n = m/M, m - масса, M - масса 1 моля вещества; R - газовая постоянная, R = 8,3144 Дж/(моль×К); T - абсолютная температура).
Теперь мы имеем 3 выражения для количества вещества: n = N/NA = m/M = V/Vm, последнее особенно удобно для газов.
Для реальных газов уравнение Менделеева-Клапейрона хорошо работает при низких давлениях. Атмосферное давление можно ещё считать низким, а в недрах Земли газы сжимаются до десятков и сотен тысяч атмосфер и перестают подчиняться этому уравнению.
Закон Авогадро позволяет по плотности газа r оценить его молярную массу M:
r= m/V = 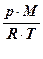 ; r1/r2 = M1/M2 = D.
; r1/r2 = M1/M2 = D.
Величину D называют относительной плотностью газа. Обычно в качестве газа сравнения используют водород с М= 2 г/моль или воздух с М= 29 г/моль.
ПРИМЕР. Плотность газа по воздуху равна 2. Найдём его молярную массу: Mгаза=D×Mвоздуха= 2×29 г/моль = 58 г/моль.
Может получиться так, что в веществе атомы соединяются прочными связями в группы, а между этими группами связь полностью или почти отсутствует.
Тогда говорят, что вещество имеет молекулярное строение.
Молекулой называют группу прочно связанных атомов, способную двигаться как единое целое. Например, участвовать в тепловом движении. Молекулы бывают одноатомные (например, у аргона Ar), двухатомные (у кислорода O2, водорода H2, азота N2, хлора Cl2), трёхатомные (у воды H2O, углекислого газа CO2) и так далее. Молекула сахара C12H22O11 содержит 45 атомов, а белки, например, гемоглобин, который переносит кислород в крови - десятки тысяч. Обычно молекулами считают только нейтральные частицы.
Если в частице вещества атомного или молекулярного размера число протонов отличается от числа электронов, то такая частица имеет электрический заряд и называется ионом. При растворении поваренной соли в воде, например, получаются положительно заряженные ионы (катионы) натрия и отрицательно заряженные ионы (анионы) хлора: Na+ и Cl-.
Очень многие вещества не состоят из молекул. Так, структура графита содержит бесконечные плоские сетки из атомов углерода. Из отдельных ионов состоят все соли.
Немолекулярны почти все вещества, слагающие земную кору: кварц, слюды, шпаты, оливин и другие минералы. По сути дела, из молекул состоят только вода и вещества нефти.
Одинаковые по виду формулы веществ совсем не означают одинакового устройства. Углекислый газ CO2 - молекулярное вещество, а кварц SiO2 - немолекулярное.
Условно строение этих веществ в твёрдом состоянии показано на схеме. В кварце на самом деле сетка связей распространяется бесконечно в трёх пространственных измерениях.
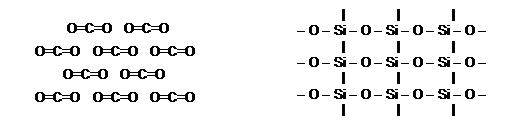 |
Как видно, формулы отражают состав, а не строение веществ. Группа SiO2 называется не молекулой, а формульной единицей. Молярной массой для немолекулярных веществ фактически называют массу числа Авогадро формульных единиц, поэтому правильнее было бы называть её формульной массой.
Для молекулярных веществ и некоторых немолекулярных выполняется закон постоянства состава: соотношения между массами элементов, входящих в состав соединения не зависят от способа получения этого соединения. Вещества постоянного состава называют дальтонидами.
Так, воду можно получить:
- взрывом смеси водорода и кислорода: 2H2+O2 ® 2H2O;
- реакцией нейтрализации: NaOH+HCl ® H2O+NaCl;
- термическим разложением гидроксидов: Cu(OH)2 ® H2O+CuO;
- обугливанием сахара: C12H22O11 ® 11H2O+12C
и многими другими способами.
Большинство немолекулярных веществ, в том числе, почти все минералы, имеет переменный состав, зависящий от способа получения. Вещества переменного состава называют бертоллидами.
Так, в оливине (Mg,Fe)2SiO4 переменным является соотношение между магнием и железом(+2). В частности, возможны чисто железистый фаялит Fe2SiO4 и чисто магниевый форстерит Mg2SiO4.
Таким образом, сейчас закон постоянства состава имеет только историческое значение - он способствовал формированию современных понятий "атом", "молекула", "уравнение реакции".
химические процессы
3. ОСНОВЫ ТЕРМОДИНАМИКИ
Термодинамика изучает передачу тепла от одних макроскопических объектов к другим. “Макроскопические объекты” - означает большие в сравнении с размером атомов и молекул.
Представьте, что мы рассматриваем какой-нибудь большой коллектив животных, например, стаю воробьёв. При этом нельзя уследить за каждым отдельным животным, но можно говорить о стае в целом. Например - стая снялась и улетела. Даже если при этом один воробей заснул и остался. Термодинамика рассматривает вещество примерно в таком же стиле.
Термодинамика анализирует поведение больших коллективов атомов и молекул, в которых действуют статистические закономерности. Типичное число частиц в коллективе - порядка числа Авогадро (6,02×10+23). Движение и энергетическое состояние каждой отдельной частицы не рассматривается. Минимальный размер коллектива - около 10-8-10-7 м по диаметру и 10+5-10+8 по числу частиц.
Примеры процессов, которые анализируются термодинамикой: кипение воды, работа двигателя внутреннего сгорания, работа холодильника, тепловые эффекты химических реакций.
Введём некоторые важные понятия, широко применяемые в термодинамике.
Системой называют набор объектов, мысленно или реально отделённых от остального мира. То, что вне системы, называется внешней средой. Между системой и внешней средой может происходить обмен веществом и энергией. Если такого обмена нет, систему называют изолированной.
По внутреннему строению системы могут быть однородными (гомогенными) и неоднородными. В однородных системах любые части диаметром порядка 10-8-10-7 м и более имеют одинаковый состав и строение. Часто неоднородность так велика, что можно провести чёткую границу: поверхность раздела. Представьте, например, плавающую льдину. Систему, в которой есть поверхности раздела, называют гетерогенной.
Внимание, теперь сложное определение: фазой называют совокупность однородных частей системы, отделённых от других её частей поверхностью раздела. Фаза может состоять и из одной однородной части. При переходе через поверхность раздела строение и свойства изменяются скачком.
Представить же это несложно: такую систему, как ведро с водой и льдом, можно разделить на две фазы - лёд и воду. Системы могут быть однофазными (воздух), двухфазными (лёд в воде) и более сложными.
Для каждой системы можно указать минимальное число химически различных веществ, достаточных для её построения. Эти вещества называют компонентами. Лёд в воде - однокомпонентная система (H2O), а воздух - многокомпонентная (N2, O2, CO2, Ar, H2O и другие газы).
Термодинамика обычно рассматривает такие свойства систем как температура T, давление p, объём V, количества компонентов ni. Их называют параметрами состояния.
Многие термодинамические системы удобно рассматривать при стандартных условиях: давлении 101325 Па (1 атм) и температуре 298,15 K (+25оС). Стандартным количеством вещества считают 1 моль.
Часто используются уравнения состояния веществ, в которые как раз и входят параметры состояния. Самое известное из них: уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
Каждая система обладает некоторым запасом энергии - его называют внутренней энергией (U). U состоит из энергии движения составляющих систему микрочастиц и энергии их взаимодействия. Мы можем изменить внутреннюю энергию системы, производя работу над ней (например, сжимая газ поршнем), нагревая или охлаждая, проводя химический процесс, Внутренняя энергия изолированной системы постоянна.
Если система взаимодействует с окружающей средой, рассматривать только U обычно недостаточно.
Прежде всего, надо обратить внимание на количество теплоты Q, которое получает или теряет система в ходе процесса. Допустим, система поглощает тепло. Это тепло расходуется на повышение внутренней энергии системы DU и совершение работы A против внешних сил (первое начало термодинамики). Обычно рассматривается работа расширения газа A=p×DV, и тогда -Q=DU+p×DV).
Если обмен энергией происходит при постоянном давлении (в изобарных условиях), то -Qp = DU+p×DV = U2-U1+p×(V2-V1) = (U2+p×V2) - (U1+p×V1) = H2-H1 =DH.
Величина H=U+p×V называется энтальпией или теплосодержанием системы. Энтальпия, в отличие от внутренней энергии, учитывает работу расширения или сжатия газа. Если в ходе процесса тепло выделяется (Qp>0, экзотермический процесс), то DH<0. Если тепло поглощается (эндотермический процесс), DH>0.
Пример процесса, идущего с поглощением тепла - растворение в воде роданида калия KSCN. Процесс, идущий с выделением тепла: разбавление водой серной кислоты H2SO4. Тепловые эффекты указывают, что растворение - химический процесс, а не простое механическое перемешивание веществ.
Если тепло поступает в систему при постоянной температуре (например, кипение жидкости), то QT = T×DS.
Величина S называется энтропией или степенью беспорядка системы. Сообщаемое тепло всегда увеличивает беспорядок в системе. Энтропия жидкостей больше, чем у твёрдых веществ. Энтропия всегда возрастает при плавлении, кипении и образовании разбавленных растворов. Особенно большой энтропией обладают газы, так как в них все молекулы движутся беспорядочно. Энтропия отвечает поступательному, колебательному и вращательному движению молекул и атомов, а также дефектам (нарушениям структур) твёрдых веществ.
Энтропия идеального кристалла при температуре 0 К равна нулю (третье начало термодинамики). В изолированной системе энтропия может повышаться, пока не достигнет максимально возможного значения. Другими словами, в природе идут самопроизвольно только процессы увеличения энтропии (второе начало термодинамики).
Значения энтропии, внутренней энергии и энтальпии системы в данный момент времени определяются только параметрами состояния системы в этот момент. Подобные величины называют в термодинамике функциями состояния.
4. ТЕРМОХИМИЯ
Изученная нами энтальпия Н широко применяется для расчётов тепловых эффектов химических реакций - термохимии.
Основным в термохимии является закон Гесса: