по использованию катализатора
Классификация химических реакций.
Химические реакции классифицируются по различным признакам.
1. По числу и составу реагирующих веществ и продуктов реакции(стр. 99, учебник Габриелян, 8 кл)
a) Реакции разложения Реакции соединения. Это такие реакции, при которых из двух и более веществ образуется одно сложное вещество. Например, S +O2 = SO2
b) . Это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ. Например, Mg(OH)2 = MgO + H2O
c) Реакции замещения. Это такие реакции, при которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. Например, Zn + 2HCl = ZnCl2 + H2
d) Реакции обмена. Это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Например, KOH + HCl = KCl + H2O
2. по агрегатному состоянию реагирующих веществ (стр. 120)
a) Гомогенные – реакции, при которых реагирующие вещества находятся в одном агрегатном состоянии. Н2 +Сl2 = 2 НСl
b) Гетерогенные - реакции, при которых реагирующие вещества находятся в разных агрегатных состояниях.
по использованию катализатора
a) Каталитические реакции, идущие с участием катализатора. 2SO2 +O2 = 2SO3
b) Некаталитические реакции, идущие без участия катализатора.KOH + HCl = KCl + H2O
4. по тепловому эффекту (стр. 95)
a) Экзотермические - это реакции, которые протекают с выделением тепла. (К ним относятся почти все реакции соединения, кроме N2+O2=2NО и H2+I2=2НI) С + О2 = СО2 + Q
b) Эндотермические это реакции, которые протекают с поглощением тепла (к ним относятся все реакции разложения). Mg(OH)2 = MgO + H2O-Q
5. по направлению (стр.129)
a) 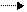
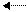 Обратимые реакции протекают одновременно в двух противоположных направлениях. 3Н2 +N2
Обратимые реакции протекают одновременно в двух противоположных направлениях. 3Н2 +N2  2 NН3
2 NН3
b) Необратимые реакции протекают при данных условиях в одном направлении. KOH + HCl = KCl + H2O К ним относятся все реакции обмена, при которых выделяется газ, осадок или вода.
6. по изменению степени окисления (стр. 173)
a) Окислительно-восстановительные реакции – это реакции, идущие с изменением степеней окисления элементов. S0 +O20 = S+4 O2-2 К ним относится множество реакций, в том числе все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество. Составим электронный баланс для уравнения
S0 – 4е = S+4 / 4/1 процесс окисления, сера является восстановителем
O20 + 4е = 2О-2 / 4/1 процесс окисления, кислород является окислителем.
Окисление – это процесс отдачи электронов, а восстановление – это процесс присоединения электронов.
Вещество, которое отдает электроны, называется восстановителем, его степень окисления возрастает. Вещество, которое присоединяет электроны, называется окислителем, его степень окисления «опускается»-понижается
b) Реакции без изменения степеней окисления. KOH + HCl = KCl + H2O