Получение замещенных дигидропиримидов. Реакция Бядженелли
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ХЕРСОНСЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ КАФЕДРА ХІМІЧНИХ ТЕХНОЛОГІЙ І БІОХІМІЧНОГО СИНТЕЗУ Херсонский национальный технический университет
Кафедра химических технологий и биохимических синтеза
ЛАБАРАТОРНИЙ ПРАКТИКУМ
Лабораторный практикум
з «Основи хімії гетероциклічних сполук» с «Основы химии гетероциклических соединений»
на тему: на тему:
«Получение замещенных дигидропиримидинов. Реакция Бядженелли»
Студента Бовтуна А.О.
м. Херсон – 2016 р.
Содержание
Реферат. 3
1. Литературный обзор. 4
1.1 Пиримидин и его производные. 4
1.2 Химические свойства. 4
1.3 Получение. 5
1.4 Производные. 5
1.5 Отдельные представители. 6
2. Практическая часть. 8
2.1 Получение замещенных дигидропиримидов. Реакция Бядженелли. 8
2.2 Бромирование производных дигидропиримидина. 8
3. Вывод. 10
4. Список использованной литературы.. 11
Реферат
В данной работе раскрывается тема про шестичленные гетероциклы с двумя атомами азота, а именно пиримидин, его химические свойства, способы получение ,использование человеком производных пиримидина в фармацевтической сфере. Также приведено схема получение пиримидина и дальнейшее бромирование полученного пиримидина.
Литературный обзор
Пиримидин и его производные
Пиримидин (C4N2H 1,3м-диазин, миазин) — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель 1,3-диазинов.
Пиримидин — бесцветные кристаллы с характерным запахом.
| Производные пиримидина | Температура плавления, °C | Температура кипения, °C |
| Пиримидин | ||
| Сульфат пиримидина | ||
| Нитрат пиримидина | ||
| Пикрат | ||
| Перхлорат | 192° |
Химические свойства
Молекулярная масса пиримидина 80,09 г/моль. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны за счет донорно-акцепторной связи, приобретая при этом положительный заряд.
Реакционная способность в реакциях электрофильного замещения у пиримидина снижена из-за снижения электронной плотности в положениях 2,4,6, вызванного наличием двух атомов азота в цикле. Так, пиримидин не нитруется и не сульфируется, однако в виде соли бромируется в положение 5.
Электрофильное замещение становится возможным только при наличии электронодонорных заместителей и направляется в наименее дезактивированное положение 5.
Под действием алкилирующих агентов (алкилгалогениды, борфторид триэтилоксония) пиримидин образует четвертичные N-пиридиниевые соли, при действии перекиси водорода и надкислот образует N-оксид.
Реакции пиридина с азотными нуклеофилами зачастую сопровождаются раскрытием кольца с дальнейшей рециклизацией: так, в жестких условиях при взаимодействии с гидразином, пиримидин образует пиразол, при взаимодействии с метиламином — 3-этил-5-метилпиридин.
Пониженная электронная плотность кольца приводит к тому, что пиримидин активен по отношению к нуклеофильным реагентам, которые атакуют 2-, 4- и 6- атомы углерода цикла.
Так, литийорганические соединения и реактивы Гриньяра присоединяются к пиримидину с образованием 4-замещенных 3,4-дигидропиримидинов. 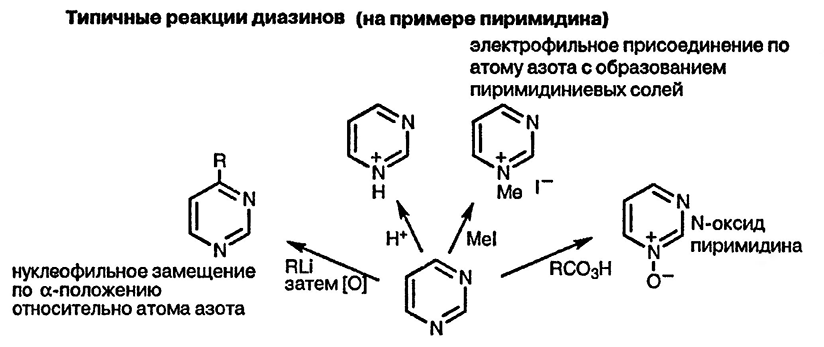
Получение
Пиримидин получают восстановлением галогенизированых пиримидиновых производных. Или из 2,4,6-трихлор пиримидина, получаемого обработкой барбитуровой кислоты хлороксидом фосфора.
Производные
Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах. В частности, такие производные как цитозин, тимин, урацил входят в состав нуклеотидов, являющихся структурными единицами нуклеиновых кислот, пиримидиновое ядро входит в состав некоторых витаминов группы B, в частности B1, коферментов и антибиотиков.

Структурная формула цитозина

Структурная формула тимина

Структурная формула урацила
Пиримидиновая структура — как ароматическая, так и гидрированная, входит в состав многих биологически активных веществ и лекарственных препаратов — например, барбитуратов — производных 1,3,5-тригидроксипиридина, обладающих снотворным, противосудорожным и наркотическим действием.
Отдельные представители
5-этил-5-(2-амил)-барбитурат

Снотворное средство
1-бензол-5-этил-5-фенилбарбитуровая кислота

Противоэлиптическое средство
Теофиллин с 1,2-этилендиамином

Бронхолитическое лекарственное средство
Меркартопурин

Анти лейкемическое средство
6-метил-1,2,3,4-тетрагидропиримидион-4-тион-2

Антиреоидное вещество (тормозит функцию щитовидной железы)
3,7-диметилксантин

Спазмолитическое и диуретическое средство
Практическая часть
Получение замещенных дигидропиримидов. Реакция Бядженелли

Методика
В трехгорной колбе снабженной механической мешалкой, установлена на водяную баню смешиваем 0,1 моль (1), 0,1 моль (2) в 100 мл спирта (изопропилового спирта), вымешиваем 20-30 мин при температуре 35-40 градусах. Отсоединяем мешалку добавляем 0,15 моль (3) , вкапываем 8 капель HCL (к) и кипятим на водяной бани в течении 60-90 мин. Реакционную смесь выливаем в фарфоровый пиар и упариваем до образование маслянистого осадка. Технический осадок кристаллизуем из ДМФА (ИПС). Выход примерно 70 %. Температура плавления-176 градусов.
Загрузка
Монометилмочевина (1)=14,8 г
Бензальдегид (2) = 28,1 г
Ацетоуксусный ефир (3) =39 мл
Растворитель = 200 мл
HCL=16 капель
Получено (4) =26,38 г с температурой плавления 135-140 градусов.